Hepatic Sarcoidosis: A Modern View on the Issue
- Autores: Strokova O.A.1, Zvereva S.I.1, Ganyushkin V.E.1
-
Afiliações:
- National Research Mordovia State University
- Edição: Volume 1, Nº 3 (2025)
- Páginas: 252-268
- Seção: Internal medicine
- ##submission.dateSubmitted##: 06.05.2025
- ##submission.dateAccepted##: 12.09.2025
- ##submission.datePublished##: 22.09.2025
- URL: https://medbiosci.ru/MedBiotech/article/view/290674
- DOI: https://doi.org/10.15507/3034-6231.001.202503.252-268
- EDN: https://elibrary.ru/fnbouq
- ID: 290674
Citar
Texto integral
Resumo
Introduction. Hepatic sarcoidosis is a chronic inflammatory disease characterized by the formation of non-caseating nodules (granulomas) in the liver tissue and associated functional impairments. Available data indicate the necessity of continuing research to clarify the mechanisms underlying the development of this pathology and to develop innovative treatment methods. The aim of this study is to analyze current scientific data on the epidemiology, etiopathogenesis, clinical manifestations, diagnostic methods, and treatment strategies for hepatic sarcoidosis.
Materials and methods. The following scientific databases were utilized: PubMed, Scopus, Web of Science, Google Scholar, and eLibrary. The search was conducted using keywords. Forty-eight publications were selected and analyzed: original articles, reviews, clinical cases, and meta-analyses published in English and Russian.
Results. Hepatic sarcoidosis is distinguished by a significant degree of heterogeneity and by the complex mechanisms underlying the formation and regression of granulomatous foci. The necessity of an interdisciplinary approach to the diagnosis and management of this disease has been clearly demonstrated. Investigation into the pathogenetic influence of cytokines and chemokines unveils promising avenues for the development of pharmaceuticals aimed at modulating inflammation and inducing remission. The application of advanced imaging and molecular techniques is crucial for the early detection of hepatic involvement and for the prevention of complications. Key objectives for future research entail the development of highly efficacious therapeutic agents with low toxicity profiles.
Discussion and conclusion. The obtained results highlight the promise of a more detailed analysis of inflammatory processes in hepatic sarcoidosis, with a particular focus on the role of the immune system and potential targets for pharmacotherapy. The importance of integrating various disciplines and fostering a multidisciplinary approach to the study of this pathology is emphasised. Advances in understanding the pathophysiology of hepatic sarcoidosis, coupled with the introduction of novel diagnostic technologies and pharmaceutical agents, are poised to significantly improve patient management strategies. The proposed research directions pave the way for the development of a personalised approach to each patient, one that minimises the risks of therapy-related adverse effects and improves disease outcomes.
Palavras-chave
Texto integral
ВВЕДЕНИЕ
Саркоидоз имеет глобальное распространение, однако заболеваемость варьирует в зависимости от региона. По имеющимся данным, частота встречаемости данного заболевания составляет 2–60 чел. на 100 тыс. населения, чаще всего страдают лица среднего возраста (30–50 лет) [1; 2; 3].
В клинические рекомендации 2025 г. добавлено международное определение саркоидоза с акцентом на мультисистемность заболевания неизвестной этиологии и поражение людей молодого и среднего возраста1.
Согласно данным ряда национальных регистров, заболеваемость саркоидозом минимальна в азиатских странах (0,47–5 на 100 тыс. чел.), в Северной Америке составляет 6,8–11 на 100 тыс. чел., в странах Северной Европы варьирует от 7 до 19 на 100 тыс. чел. Заболеваемость в регионах Российской Федерации колеблется от 2,6 до 3,9 на 100 тыс. населения2.
Женщины подвержены этому заболеванию несколько чаще мужчин, хотя некоторые авторы утверждают об отсутствии значительных гендерных различий [4; 5].
Несмотря на то, что подавляющее большинство случаев составляет легочная форма саркоидоза, в патологический процесс вовлекаются практически все органы и системы, в том числе и печень. Частота поражения печени, по данным различных источников, варьирует от 20–30 % до 66–80 % случаев [6; 7]. Вовлечение печени в патологический процесс при саркоидозе нередко приводит к нарушению ее функций, а в 1 % случаев – к циррозу печени и портальной гипертензии [7]. Хотя данное заболевание известно уже долгое время, многие аспекты его этиологии и патогенеза остаются недостаточно изученными.
Саркоидоз печени представляет собой гетерогенную патологию, характеризующуюся сложностью патогенетических механизмов и недостаточной изученностью, что обусловливает необходимость комплексного междисциплинарного подхода к диагностике и лечению. Современные достижения медицинской науки позволяют эффективно управлять течением заболевания и существенно повышать качество жизни пациентов. Тем не менее, фундаментальные аспекты патогенеза, такие как формирование характерных гранулем и пути их регрессии, требуют дополнительного изучения. Важнейшими задачами являются углубленное исследование роли иммунологических медиаторов – цитокинов и хемокинов, что потенциально откроет новые горизонты для разработки целевых лекарственных средств, способных модулировать воспалительные процессы и индуцировать ремиссию. Оптимизация диагностических протоколов посредством внедрения передовых методов визуализации и молекулярно-биологических маркеров имеет критическое значение для раннего выявления печеночных поражений при системном саркоидозе и профилактики развития серьезных осложнений. Параллельно с этим разработка инновационных терапевтических стратегий, ориентированных на снижение токсичности и повышение клинической эффективности, остается одной из главных целей исследовательской деятельности в этой области.
Цель обзора – анализ современных научных данных об эпидемиологии, этиопатогенезе, клинических проявлениях саркоидоза печени, диагностических алгоритмах и терапевтических стратегиях с выделением ключевых направлений исследований.
МАТЕРИАЛЫ И МЕТОДЫ
Поиск осуществлялся в научных базах данных PubMed, Scopus, Web of Science, Google Scholar, eLibrary. Критерии отбора: период издания – 2002–2025 гг., доступность полного текста публикации, соответствие ключевым словам. Проанализированы оригинальные публикации, обзоры, клинические наблюдения и метаанализы на английском и русском языках. Качество источников оценивалось по степени сопряженности с тематикой данного обзора, наглядности иллюстративного материала, количеству цитирований. Критерии исключения: размещение в открытом доступе только аннотации статьи, описание коморбидных состояний, ретрагированная статья. Для усиления доказательной базы сравнили отечественные клинические рекомендации 2022 и 2025 гг.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Поражение печени при саркоидозе отмечается довольно часто, однако клинические манифестации наблюдаются лишь у 20–30 % пациентов [8]. Вероятнее всего, это объясняется высокими компенсаторными возможностями печени, благодаря которым даже значительные изменения в органе могут оставаться незамеченными длительное время.
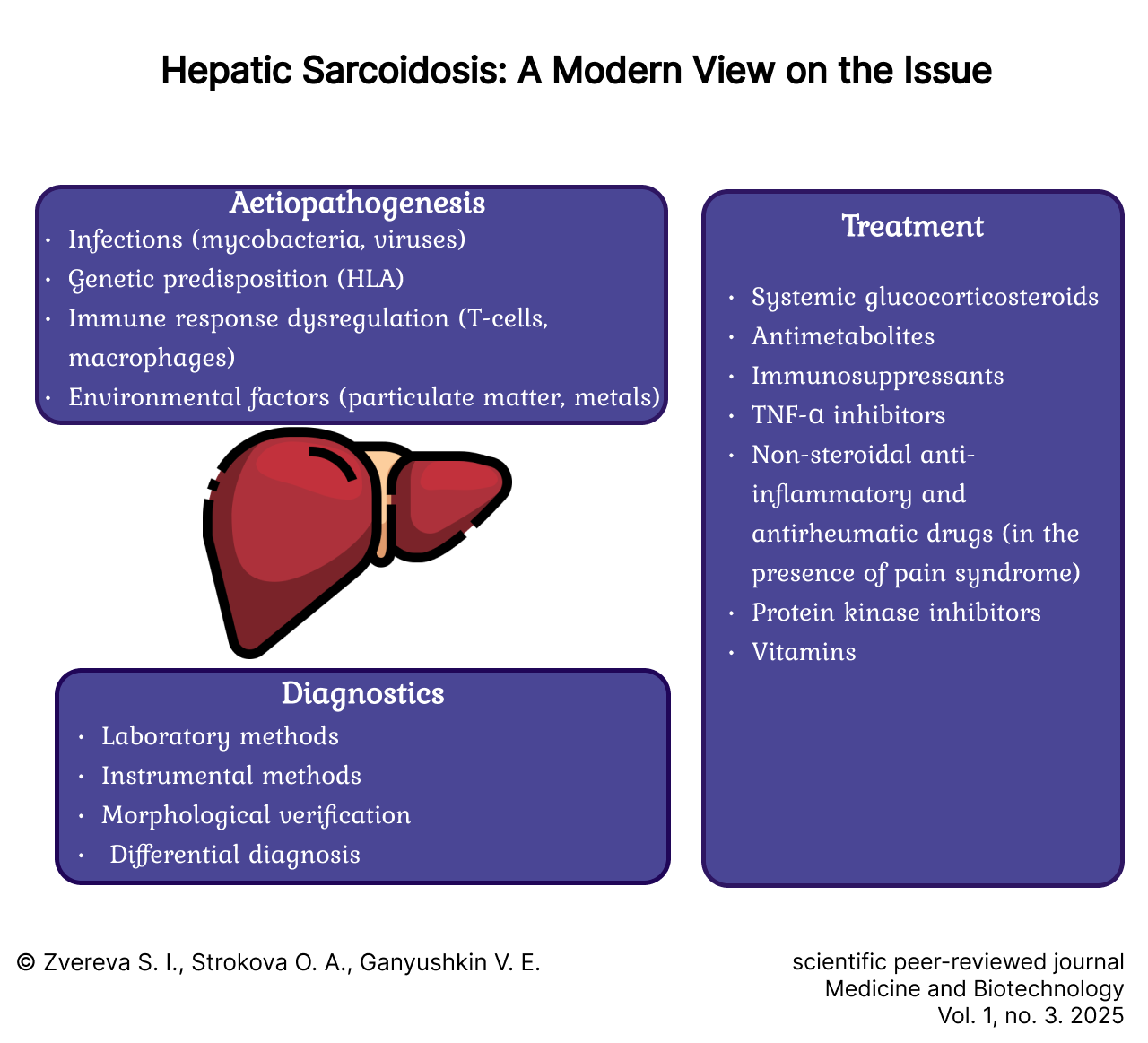
Этиопатогенез до настоящего времени изучен недостаточно, и механизмы развития саркоидоза остаются предметом активных исследований. Существует несколько гипотез, объясняющих его возникновение. К наиболее вероятным относят инфекционную теорию, генетическую предрасположенность, неадекватность иммунологической реакции организма, а также влияние внешней среды.
Инфекционная теория. Предполагается, что определенные инфекции могут инициировать иммунную реакцию, приводящую к формированию гранулем. Среди потенциальных инфекционных агентов упоминаются микобактерии туберкулеза, пропионовокислые бактерии, боррелии3, вирусы гепатита B и C, хламидии [9]. Для выяснения потенциальной роли микроорганизмов в патогенезе этого заболевания необходимы дальнейшие исследования с участием большего числа пациентов и соответствующим контролем.
Генетическая предрасположенность. Генетические факторы играют важную роль в развитии саркоидоза. Так, некоторые аллели генов главного комплекса гистосовместимости (HLA-DQB1*06:02 и HLA-DQB1*06:04) связаны с повышенной вероятностью заболевания [10]. Имеются указания на ассоциацию высокого риска развития саркоидоза с однонуклеотидными полиморфизмами в генах, кодирующих молекулы ряда цитокинов: интерлейкина (IL)-1A, IL-12B, IL-18, интерферона-γ, туморнекротизирующего фактора (TNF)-α, васкулоэндотелиального фактора A, и хемокиновых рецепторов: CCR2, CCR5, регулирующих миграцию моноцитов из костного мозга в очаг воспаления, активацию, выживание и удержание макрофагов в центре гранулемы4.
Иммунологическая реакция. Считается, что саркоидоз возникает в результате дисрегуляции иммунной системы, особенно гиперреактивности Т-клеток и макрофагов, с формированием гранулем, состоящих из эпителиоидных клеток, гигантских многоядерных клеток и лимфоцитов [11]. К часто наблюдаемым иммунологическим признакам отнесены: угнетение кожной гиперчувствительности замедленного типа и повышенный иммунный ответ Т-хелперов 1 типа в очагах заболевания. Отмечается вероятность обнаружения циркулирующих иммунных комплексов и признаков гиперактивности В-клеток5,6.
Влияние внешней среды. Некоторые химические элементы, такие как бериллий, кремний и алюминий, могут способствовать развитию саркоидоза. Курение и другие факторы также могут играть роль в возникновении заболевания [11; 12].
Клинические проявления
Известно, что при саркоидозе поражается преимущественно легочная ткань (до 90 %), однако у 50–80 % пациентов с системным саркоидозом при биопсии печени и/или аутопсии выявляется ее патология. В то же время повышение уровня активности аминострансфераз выявляется только у 10–30 % больных саркоидозом, а увеличение печени при физикальном обследовании пациента – лишь у 15–20 % пациентов с саркоидозом печени, такое несоответствие вероятнее всего объясняется бессимптомностью течения заболевания [3; 13; 14]. При клинических манифестациях саркоидоза печени у пациентов они отличаются вариабельностью и зависят от степени поражения органа [8; 15; 16].
У больных с данным диагнозом часто имеются неспецифические жалобы, такие как повышенная утомляемость, субфебрильная лихорадка, боли в суставах, которые могут указывать на активность процесса в печени [14].
Гепатомегалия является одним из наиболее частых признаков саркоидоза печени. Как правило, она носит умеренный характер и не сопровождается болевым синдромом. Тем не менее, у некоторых пациентов может возникать боль или чувство дискомфорта в правом подреберье, что, по-видимому, является следствием растяжения глиссоновой капсулы [17].
Желтуха встречается относительно редко (менее чем у 5 % больных), она может возникнуть при тяжелом течении болезни или развитии осложнений, таких как цирроз печени [18]. Клинические манифестации желтухи обычно включают желтушность кожных покровов и слизистых оболочек, темную окраску мочи и ахолию кала.
Синдром холестаза представляет собой характерный признак печеночного саркоидоза, имеет вариабельный характер этиопатогенеза. Гепатоцеллюлярная форма холестаза возникает вследствие прогрессирования инфильтративных изменений паренхимы печени, тогда как холангиоцеллюлярный вариант обусловлен развитием различных типов холангита, включая негнойную деструкцию и фиброзно-облитерирующие процессы. Компрессия билиарной системы саркоидозными образованиями также способна привести к развитию холестатического синдрома [1].
Длительное течение саркоидоза печени примерно в 30 % случаев может инициировать развитие портальной гипертензии, которая проявляется спленомегалией, асцитом и варикозным расширением вен портокавальных анастомозов [16]. С другой стороны, портальная гипертензия может возникнуть также из-за гранулематозной обструкции кровотока через портальное кровообращение, развития тромбоза воротной вены или синдрома Бадда – Киари [8; 19].
В редких случаях, особенно при обширном поражении печени, может развиться печеночная недостаточность, приводящая к нарушению ее основных функций, таких как синтез белков, детоксикация и метаболизм лекарственных веществ. Это состояние может сопровождаться развитием печеночной энцефалопатии, коагулопатий и других серьезных осложнений вплоть до летального исхода [20; 21].
В таблице 1 представлены основные проявления поражения печени при саркоидозе и их причины.
Таблица 1. Проявления патологии печени при саркоидозе и их причины
Table 1. Manifestations of liver pathology in sarcoidosis and their causes
Проявления патологии печени / Manifestations of liver pathology | Причины / Reasons |
Желтуха / Jaundice | Холестаз / Cholestasis Обструкция протоков / Duct obstruction Сдавление саркоидными массами / Compression by sarcoid masses Гепатоцеллюлярная карцинома / Hepatocellular carcinoma |
Цирроз / Cirrhosis | Фиброз вследствие формирования гранулем / Fibrosis due to granuloma formation Флебиты / Phlebitis Вторичный билиарный цирроз / Secondary biliary cirrhosis |
Портальная гипертензия / Portal hypertension | Внутрипеченочная пресунусоидальная обструкция / Intrahepatic presunusoidal obstruction Тромбоз портальной вены / Portal vein thrombosis Тромбоз печеночных вен / Thrombosis of hepatic veins |
Асцит / Ascites | Цирроз и портальная гипертензия / Cirrhosis and portal hypertension Легочное сердце / Pulmonary heart Гипоальбуминемия / Hypoalbuminemia Поражение внутрибрюшных лимфатических узлов / Damage to intra-abdominal lymph nodes Хилезный асцит / Chyletic ascites |
Источник: таблица составлена авторами
Source: the table is compiled by the authors
Диагностика
Диагностика саркоидоза печени характеризуется высокой сложностью, так как отсутствуют специфические биомаркеры, однозначно подтверждающие наличие данного заболевания. В связи с этим для постановки точного диагноза используется комплексный подход, включающий различные лабораторные и инструментальные исследования.
Лабораторные методы исследования. В рамках стандартного обследования пациентов с саркоидозом любой локализации нередко обнаруживается анемия. При острой фазе болезни может наблюдаться увеличение скорости оседания эритроцитов, лейкоцитоз, лимфопения, моноцитоз, а также повышение индекса Кребса, отражающего соотношение между количеством нейтрофилов и лимфоцитов [7]. Вследствие нарушений функций печени может развиться тромбоцитопения, что требует дифференциальной диагностики с аутоиммунной тромбоцитопенической пурпурой [22].
В случаях саркоидного поражения печени в первую очередь следует обратить внимание на активность печеночных энзимов, билирубина, альбумина, глюкозы и электролитов крови. Повышение активности аминотрансфераз, таких как аланиновая (АЛТ) и аспарагиновая (АСТ), указывает на воспалительный процесс в печени, а повышение в 5–10 раз активности щелочной фосфатазы (ЩФ) и гамма-глутамилтрансферазы (ГГТ) – на явления холестаза [18; 23]. В популяционном исследовании, проведенном Bodwal J. и соавт., показано, что в результатах химического исследования печени повышение уровней АЛТ и АСТ встречалось реже, чем повышение ЩФ, что свидетельствует об инфильтративной природе саркоидных гранулем с последующим холестатическим повреждением печени и, в меньшей степени, гепатоцеллюлярной деструкцией [21]. Гипербилирубинемия встречается гораздо реже [24; 25]. Отмечается, что при саркоидозе печени возможно повышение уровня общего и прямого билирубина [26; 27]. Важно помнить, что подобные изменения не обладают строгой специфичностью по отношению к саркоидозу и могут возникать при других патологиях печени [25].
Рекомендуется исследовать уровень ангиотензиногена, его производных и ангиотензин-превращающего фермента (АПФ) в сыворотке крови подросткам и взрослым при первичном выявлении и в динамике для оценки активности заболевания при подозрении на прогрессирование саркоидоза. Клинически значимым считается увеличение активности сывороточного АПФ более 150 % от верхней границы нормы (в возрасте 6–18 лет – 112 единиц, в возрасте более 18 лет – 70 единиц)7.
Биохимические исследования крови позволяют выявить поликлональную гипергаммаглобулинемию (50 % случаев), гиперкальциемию (5–11 %), гиперпролактинемию (3–32 %) [28; 29]. Гиперкальцийурия встречается в 25 % случаев и является более точным методом выявления нарушения метаболизма кальция. У многих больных уровень кальция крови может быть снижен, изменения данного параметра следует учитывать при назначении глюкокортикоидов, индуцирующих развитие остеопороза [30].
Исследование уровней иммуноглобулинов A, M, G в крови рекомендуется при первичном обследовании для дифференциальной диагностики с иммунодефицитными состояниями с образованием гранулем, общей вариабельной иммунной недостаточностью8.
Серологическое тестирование может выявить антитела к потенциальным инфекционным агентам [9].
Инструментальные методы исследования. Ввиду сложностей клинико-лабораторной верификации саркоидоза различной локализации ключевое значение для постановки диагноза приобретают методы медицинской визуализации. Ультразвуковое сканирование абдоминальной полости показано всем пациентам с саркоидозом при наличии клинических признаков поражения печени. При вовлечении печени в патологический процесс отмечаются такие сонографические признаки, как гетерогенная структура паренхиматозной ткани, крупнозернистость эхоплотности, очаговые участки кальцификатов и неровность краевых контуров органа [8; 31]. С целью выявления и определения стадии фиброза при саркоидозе печени показана эластометрия.
Компьютерная томография и магнитно-резонансная томография позволяют получить более детальную информацию о состоянии печени и окружающих структур.
Биопсия печени признана «золотым стандартом» в установлении диагноза, поскольку позволяет подтвердить наличие гранулем, являющихся ключевым морфологическим признаком саркоидоза. Биопсия имеет важное значение и для исключения других возможных причин поражения печени, таких как неалкогольная жировая болезнь печени, первичный билиарный холангит (ПБХ), который отрицателен по антимитохондриальным антителам, первичный склерозирующий холангит (ПСХ) мелких желчных протоков и токсический гепатит, вызванный приемом лекарственных средств.
Как и при ПБХ и ПСХ, саркоидоз может стать причиной образования портальных гранулем, развития лимфоцитарного холангита, повреждения и деструкции желчных протоков, их стеноза и хронической желчной гипертензии. Вследствие этого нельзя ограничиваться исключительно результатами гистопатологического исследования [32; 33].
Для окончательного подтверждения диагноза необходимо соблюдение ряда критериев, среди которых: наличие характерных клинико-рентгенологических признаков, соответствующих данному заболеванию; выявление неказеифицированных гранулем в биоптате, что является патогномоничным признаком саркоидоза; исключение других патологий со схожей клинической картиной, таких как туберкулез, микозы и лимфопролиферативные заболевания [34].
Дифференциальная диагностика
Это ключевой этап медицинского обследования, направленный на исключение ряда заболеваний различной этиологии и патогенеза. В частности, данный процесс позволяет провести тщательное разграничение между такими нозологическими единицами, как туберкулез, который характеризуется хроническим инфекционным процессом, вызванным микобактериями туберкулеза, и гепатоцеллюлярной карциномой – злокачественной опухолью печени, возникающей вследствие мутаций клеток печеночной паренхимы. Кроме того, дифференциальная диагностика необходима при подозрении на первичный билиарный холангит, представляющий собой хроническое воспалительное заболевание междольковых и септальных желчных протоков, а также другие аутоиммунные патологии, включая системную красную волчанку, ревматоидный артрит и болезнь Крона.
Выявление у больных геморрагического синдрома вследствие тромбоцитопении потребует дифференциации с аутоиммунной тромбоцитопенической пурпурой [22].
Увеличение количества иммуноглобулинов A, M, G в крови при отсутствии абсолютной нейтропении и сохраненной кислородзависимой цитотоксичности нейтрофилов позволит дифференцировать заболевание от иммунодефицитных состояний системы фагоцитов с образованием гранулем9.
Учитывая мультисистемный характер саркоидоза, требуется привлечение специалистов разного профиля для проведения комплексной оценки, направленной на подтверждение или исключение вовлечения других органов и систем в патологический процесс. Проведение дифференциальной диагностики обеспечивает точность постановки диагноза и выбор адекватного лечения, минимизируя риски неправильного терапевтического подхода [35].
Терапия
Основная цель терапевтического подхода у пациентов с саркоидозом заключается в профилактике и устранении жизнеугрожающих состояний, а также минимизации риска осложнений, обусловленных локализацией патологических изменений, с учетом индивидуальных особенностей течения заболевания и состояния здоровья каждого конкретного пациента. В случае поражения печени лечение должно быть направлено на снижение воспалительных процессов и предотвращение ее дальнейшего повреждения.
В первую очередь необходимо информировать пациента о важности соблюдения специальной диеты со сниженным потреблением жиров и повышенным содержанием белков. Такой подход направлен на уменьшение нагрузки на печень, снижение уровня липидных отложений в ее тканях и обеспечение достаточного количества аминокислот, необходимых для регенерации поврежденных гепатоцитов. Ограничение потребления жиров помогает предотвратить развитие стеатогепатита – состояния, при котором происходит накопление жира в клетках печени, что может усугубить течение основного заболевания. Высокобелковая диета, напротив, стимулирует синтез структурных и ферментативных белков, обеспечивая восстановление клеточных мембран и улучшение метаболических процессов в органе. Таким образом, соблюдение данного режима питания является неотъемлемой частью комплексного подхода к управлению состоянием пациентов с саркоидозом печени. Прием витаминов группы B, фолиевой кислоты и антиоксидантов рекомендуется для улучшения общего состояния организма [36; 37].
Согласно клиническим рекомендациям, пациентам на ранних стадиях саркоидоза при наличии ожирения показана разгрузочно-диетическая терапия, которая предусматривает подготовительный период – 3–7 дней, лечебное голодание – 7–14 дней, восстановительный период – 7 дней. Данный метод активирует процессы саморегуляции по механизму эустресса и обладает саногенетическим действием, способствует улучшению клинико-рентгенологической картины, повышению антиоксидантов и коррекции иммунной реактивности организма10.
Современной стратегией терапии является сопоставление необходимости назначения лечения с тяжестью последствий от применения кортикостероидной, цитостатической и биологической (таргетной) терапии.
Основные фармакологические препараты, применяемые в лечении саркоидоза, представлены в таблице 2.
Таблица 2. Фармакологические классы препаратов, используемые в терапии саркоидоза
Table 2. Pharmacological classes of drugs used in the treatment of sarcoidosis
Фармакологический класс / Pharmacological class | Препараты / Medicaments |
Системные глюкокортикостероиды / Systemic glucocorticosteroids | Преднизолон / Prednisone Метилпреднизолон / Methylprednisolone |
Антиметаболиты / Antimetabolites Иммунодепрессанты / Immunosuppressants | Метотрексат / Methotrexate Азатиоприн / Azathioprine Хлорохин / Chloroquine Гидроксихлорохин / Hydroxychloroquine Микофенолата мофетил / Mycophenolate mofetil Лефлуномид / Leflunomide Циклофосфамид / Cyclophosphamide |
Ингибиторы TNF-α / TNF-α inhibitors | Пентоксифиллин / Pentoxifylline Инфликсимаб / Infliximab Адалимумаб / Adalimumab |
Нестероидные противовоспалительные и противоревматические препараты (при наличии болевого синдрома) / Nonsteroidal anti-inflammatory and antirheumatic drugs (in the presence of pain syndrome) | Индометацин / Indomethacin Диклофенак / Diclofenac Ибупрофен / Ibuprofen Нимесулид / Nimesulide Эторикоксиб / Etoricoxib |
Ингибиторы протеинкиназы / Protein kinase inhibitors | Нинтеданиб / Nintedanib |
Витамины / Vitamins | Альфа-токоферола ацетат (витамин Е) / Alpha-Tocopherol Acetate (vitamin E) |
Источник: составлено авторами статьи по материалам [7]
Source: compiled by the authors of the article based on the materials [7]
Системные глюкокортикостероиды (СГКС) рассматриваются как препараты выбора для начальной терапии у пациентов с прогрессирующим течением саркоидоза, обеспечивая эффективное управление воспалительным процессом и предотвращение дальнейшего развития заболевания [7]. Их основное действие заключается в подавлении воспалительных реакций за счет ингибирования синтеза провоспалительных цитокинов, уменьшения миграции лейкоцитов к очагу воспаления, снижения пролиферации лимфоцитов и макрофагов, что приводит к уменьшению образования гранулем [38; 39].
Согласно имеющимся данным, применение кортикостероидов может способствовать регрессии гранулем, что уменьшает болевые ощущения, связанные с гепатомегалией [40]. Показаниями к назначению кортикостероидов при саркоидозе печени могут служить такие симптомы, как повышенная утомляемость, лихорадка, потеря массы тела и кожный зуд. Дозировка преднизолона подбирается индивидуально в зависимости от тяжести клинической картины: при умеренно выраженных симптомах рекомендуется принимать препарат в суточной дозе 10–20 мг, тогда как при тяжелых проявлениях заболевания дозу увеличивают вдвое – до 20–40 мг в день [8; 41]. Длительность лечения зависит от динамики уменьшения симптоматики. Некоторые специалисты считают, что терапия глюкокортикоидами в постоянной дозировке должна продолжаться не менее 12 недель, после чего возможно постепенное снижение дозы препарата [42].
При саркоидозе печени применение урсодезоксихолевой кислоты (УДХК) обосновано необходимостью обеспечения гепатопротекторного эффекта, направленного на минимизацию повреждения гепатоцитов вследствие воспалительных процессов, а также оптимизации функциональной активности органа. Подбор дозировки осуществляется строго индивидуально, исходя из таких факторов, как масса тела пациента, степень тяжести поражения паренхимы печени и наличие сопутствующих патологий. Начальная терапевтическая доза обычно варьируется в пределах 10–15 мг/кг массы тела в сутки, которая распределяется на 2–3 приема. Продолжительность курса терапии может составлять несколько месяцев, либо достигать одного года и более, что определяется динамикой течения патологического процесса и ответом организма на проводимое лечение [43; 44].
При положительной динамике пациентам с саркоидозом печени необходимо продолжать поддерживающую терапию.
Применение других иммуносупрессивных и противовоспалительных средств в терапии саркоидоза носит вспомогательный характер и используется преимущественно в качестве альтернативного метода лечения, если СГКС оказываются неэффективными или их назначение невозможно вследствие индивидуальной непереносимости, противопоказаний, связанных с сопутствующими заболеваниями, либо при наличии иных ограничений, обусловленных особенностями организма пациента. Препаратом выбора в настоящее время является метотрексат, обладающий иммуносупрессивным действием, которое выражается в снижении активности иммунной системы путем торможения пролиферативных процессов в клетках, участвующих в иммунном ответе. В частности, метотрексат блокирует синтез ДНК и РНК, тем самым препятствуя размножению клеток, вовлеченных в воспаление, что способствует замедлению прогрессирования болезни и уменьшению выраженности симптомов. Однако потенциальная гепатотоксичность метотрексата может ограничить его применение при вовлечении печени в патогенетический процесс [39].
Схема терапии пациентов с саркоидозом печени в соответствии с клиническими рекомендациями представлена на рисунке 1.
Рис. 1. Алгоритм лечения пациентов с саркоидозом печени
Fig. 1. Treatment algorithm for patients with liver sarcoidosis
Примечания: СГКС – системные глюкокортикостероиды, УДХК – урсодезоксихолевая кислота, МТТ – метотрексат, АЗА – азатиоприн, ЛЕФ – лефлуномид, ГХХ –гидроксихлорохин
Notes: SGCS – systemic glucocorticosteroids, UDCA – ursodeoxycholic acid, MTT – methotrexate, AZA – azathioprine, LEF – leflunomide, HCQ –hydroxychloroquine
Источник: составлено авторами статьи по материалам клинических рекомендаций
Source: compiled by the authors of the article based on the materials clinical guidelines
Нестероидные противовоспалительные средства (НПВС), такие как ибупрофен, диклофенак и напроксен, могут использоваться в рамках комплексного подхода к лечению саркоидоза печени для купирования болевых ощущений и уменьшения интенсивности воспалительного процесса, в частности при синдроме Лефгрена [7]. Основной механизм действия НПВС заключается в ингибировании циклооксигеназ, участвующих в биосинтезе простагландинов – ключевых медиаторов воспаления. НПВС способствуют снижению воспалительной реакции, облегчая боль и улучшая общее состояние пациента [45]. Однако из-за ассоциации с развитием ряда нежелательных побочных эффектов (эрозивно-язвенных поражения желудка и/или двенадцатиперстной кишки, кровотечения) назначение НПВС требует тщательного контроля со стороны врача, особенно пациентам с заболеваниями желудочно-кишечного тракта или другими факторами риска [46].
Хирургическое вмешательство при саркоидозе печени возможно в редких случаях, когда медикаментозная терапия оказывается безуспешной; может рассматриваться возможность трансплантации печени [47; 48].
Программа медицинской реабилитации пациентов с данным заболеванием не разработана. Эффективными могут быть следующие компоненты: лечебный режим, соблюдение диеты, физическая реабилитация (активная / пассивная), физиотерапия, психодиагностика и психокоррекция, профилактика и коррекция сопутствующей патологии, обучение пациента (усиление мотивации к лечению и здоровому образу жизни)11.
ОБСУЖДЕНИЕ И ЗАКЛЮЧЕНИЕ
Саркоидоз печени представляет собой сложное и не до конца изученное заболевание, требующее комплексного междисциплинарного подхода для точной диагностики и адекватной терапии. Несмотря на достижения современной медицины, позволяющей эффективно контролировать течение заболевания и улучшать качество жизни пациентов, многие аспекты патогенеза этого состояния остаются неясными.
Понимание механизмов формирования гранулем, характерных для саркоидоза, а также поиск эффективных методов их регрессии представляют собой актуальные задачи, решение которых имеет важное значение для разработки персонализированных подходов к лечению.
Кроме того, необходимо дальнейшее совершенствование диагностических алгоритмов, включая применение современных визуализационных технологий и молекулярно-биологических маркеров, что позволит своевременно выявлять поражение печени при системном саркоидозе и предотвращать развитие осложнений.
Изучение роли иммунологических факторов, таких как цитокины и хемокины, может открыть новые перспективы в создании таргетных препаратов, способных модулировать воспалительный ответ и способствовать ремиссии заболевания. Определенные успехи в достижении иммуносупрессии путем применения иммунодепрессантов и моноклональных антител – ингибиторов TNF-α достигнуты, но риск развития побочных эффектов или непереносимость препаратов требует разработки и применения лекарственных средств, действующих на другие фармакологические мишени. Перспективным представляется использование ингибиторов CD20 – ритуксимаба12.
Таким образом, разработка новых терапевтических стратегий, направленных на минимизацию побочных эффектов и повышение эффективности лечения саркоидоза печени является приоритетным направлением исследований.
1 Саркоидоз: клинические рекомендации. 2025 г. URL: https://spulmo.ru/upload/sarkoidoz_2025.pdf (дата обращения: 05.05.2025).
2 Саркоидоз: клинические рекомендации. 2022 г. URL: https://spulmo.ru/upload/sarkoidoz_2022.pdf (дата обращения: 05.05.2025).
3 Саркоидоз: клинические рекомендации. 2022 г.
4 Саркоидоз: клинические рекомендации. 2025 г.
5 Там же.
6 Bonella F., Culver D.A., Israël-Biet D., eds. Sarcoidosis (ERS Monograph). Sheffield, European Respiratory Society, 2022. https://doi.org/10.1183/2312508X.10031020.
7 Саркоидоз: клинические рекомендации. 2025 г.
8 Там же.
9 Саркоидоз: клинические рекомендации. 2025 г.
10 Саркоидоз: клинические рекомендации. 2025 г.
11 Саркоидоз: клинические рекомендации. 2025 г.
12 Саркоидоз: клинические рекомендации. 2025 г.
Sobre autores
Olga Strokova
National Research Mordovia State University
Email: strokovaoa@rambler.ru
ORCID ID: 0000-0003-2774-327X
Cand.Sci. (Med.), Associate Professor, Department of Internal Medicine Propaedeutics
Rússia, 68 Bolshevistskaya St., Saransk 430005Svetlana Zvereva
National Research Mordovia State University
Autor responsável pela correspondência
Email: svzvereva@mail.ru
ORCID ID: 0009-0000-4223-660X
Cand.Sci. (Med.), Associate Professor, Department of Internal Medicine Propaedeutics
Rússia, 68 Bolshevistskaya St., Saransk 430005Vladislav Ganyushkin
National Research Mordovia State University
Email: vladganuskin@gmail.com
ORCID ID: 0009-0002-2947-9433
Assistant, Department of Internal Medicine Propaedeutics
Rússia, 68 Bolshevistskaya St., Saransk 430005Bibliografia
- Tadros M., Forouhar F., Wu G.Y. Hepatic Sarcoidosis. Journal of Clinical and Translational Hepatology. 2013;1:87–93. https://doi.org/10.14218/JCTH.2013.00016
- Culver D.A. Sarcoidosis. Immunology and Allergy Clinics of North America. 2012;32(4):487–511. https://doi.org/10.1016/j.iac.2012.08.005
- Ghoneim S., Williams S.D. Hepatic Sarcoidosis: An Uncommon Cause of Cirrhosis. Cureus. 2019;11(12):e6316. https://doi.org/10.7759/cureus.6316
- Coash M., Forouhar F., Wu C.H., Wu G.Y. Granulomatous Liver Diseases: A Review. Journal of the Formosan Medical Association. 2012;111(1):3–13. https://doi.org/10.1016/j.jfma.2011.11.023
- Fomin V.V., Brovko M.Yu., Kalashnikov M.V., Sholomova V.I., Rozina T.P., Akulkina L.A. et al. Hepatic Involvement in Sarcoidosis. Therapeutic Archive Journal. 2019:91(4):4–12. https://doi.org/10.26442/00403660.2019.04.000179
- Valeyre D., Prasse A., Nunes H., Uzunhan Y., Brillet P.Y., Müller-Quernheim J. Sarcoidosis. The Lancet. 2014;383(9923):1155–1167. https://doi.org/10.1016/S0140-6736(13)60680-7
- Chuchalin A.G., Avdeev S.N., Aisanov Z.R., Baranova O.P., Borisov S.E., Geppe N.A. et al. Sarcoidosis: Federal Clinical Guidelines for Diagnosis and Treatment. Pulmonologiya. 2022;32(6):806–833. (In Russ., abstract in Eng.). https://doi.org/10.18093/0869-0189-2022-32-6-806-833
- Ebert E.C., Kierson M., Hagspiel K.D. Gastrointestinal and Hepatic Manifestations of Sarcoidosis. The American Journal of Gastroenterology. 2008;103(12):3184–3192. https://doi.org/10.1111/j.1572-0241.2008.02202.x
- Eishi Y., Suga M., Ishige I., Kobayashi D., Yamada T., Takemura T. et al. Quantitative Analysis of Mycobacterial and Propionibacterial DNA in Lymph Nodes of Japanese and European Patients with Sarcoidosis. Journal of Clinical Microbiology. 2002;40(1):198–204. https://doi.org/10.1128/JCM.40.1.198-204.2002
- Sikorova K., Osoegawa K., Kocourkova L., Strnad A., Petrkova J., Fernandez-Viña M.A. et al. Association between Sarcoidosis and HLA Polymorphisms in a Czech Population from Central Europe: Focus on a Relationship with Clinical Outcome and Treatment. Frontiers in Medicine (Lausanne). 2023;10:1094843. https://doi.org/10.3389/fmed.2023.1094843
- Beijer E., Veltkamp M., Meek B., Moller D.R. Etiology and Immunopathogenesis of Sarcoidosis: Novel Insights. Seminars in Respiratory and Critical Care Medicine. 2017;38(4):404–416. https://doi.org/10.1055/s-0037-1603087
- Newman K.L., Newman L.S. Occupational Causes of Sarcoidosis. Current Opinion in Allergy and Clinical Immunology. 2012;12(2):145–150. https://doi.org/10.1097/ACI.0b013e3283515173
- Frye B.C., Schupp J.C., Köhler T.L., Müller-Quernheim J. Diagnosis and Treatment of Sarcoidosis. Current Standards. Internist (Berl). 2015;56(12):1346–1352. (In Germ.). https://doi.org/10.1007/s00108-015-3757-1
- Muhanna A., Al Momani L., Likhitsup A. Sarcoidosis Manifesting as Liver Granuloma with Asteroid Bodies. Cureus. 2021;13(9):e17915. https://doi.org/10.7759/cureus.17915
- Cremers J.P., Drent M., Baughman R.P., Wijnen P.A., Koek G.H. Therapeutic Approach of Hepatic Sarcoidosis. Current Opinion in Pulmonary Medicine. 2012;18(5):472–482. https://doi.org/10.1097/MCP.0b013e3283541626
- Harder H., Büchler M.W., Fröhlich B., Ströbel P., Bergmann F., Neff W. et al. Extrapulmonary Sarcoidosis of Liver and Pancreas: A Case Report and Review of Literature. World Journal of Gastroenterology. 2007;13(17):2504–2509. https://pubmed.ncbi.nlm.nih.gov/17552036/ (accessed: 12.08.2025)
- Fauter M., Rossi G., Drissi-Bakhkhat A., Latournerie M., Gerfaud-Valentin M., Durieu I. et al. Hepatic Sarcoidosis with Symptomatic Portal Hypertension: A Report of 12 Cases with Review of the Literature. Frontiers in Medicine (Lausanne). 2022;9:995042. https://doi.org/10.3389/fmed.2022.995042
- Dulai P.S., Rothstein R.I. Disseminated Sarcoidosis Presenting as Granulomatous Gastritis: A Clinical Review of the Gastrointestinal and Hepatic Manifestations of Sarcoidosis. Journal of Clinical Gastroenterology. 2012;46(5):367–374. https://doi.org/10.1097/MCG.0b013e318247106b
- Van Houten L., Horst M., Samii S. Sarcoidosis with Hepatic Involvement in a 60-year-old Patient. Journal of Radiology Case Reports. 2022;16(3):23–32. https://doi.org/10.3941/jrcr.v16i3.4191
- Ibrahim A.M., Bhandari B., Soriano P.K., Quader Z., Gao J.Z., Shuster D. et al. Hepatic Involvement in Systemic Sarcoidosis. The American Journal of Case Reports. 2018;19:1212–1215. https://doi.org/10.12659/AJCR.910600
- Bodwal J., Napoleone M., Herath J. Post-mortem CT with Macroscopic and Microscopic Correlation in a Case of Sudden Death due to Systemic Sarcoidosis. Forensic Science, Medicine, and Pathology. 2020;16(3):544–547. https://doi.org/10.1007/s12024-020-00259-8
- Barlas A., Ramachandran L. Immune Thrombocytopenic Purpura Secondary to Sarcoidosis. Maedica (Bucur). 2022;17(1):234–236. https://doi.org/10.26574/maedica.2022.17.1.234
- Cremers J., Drent M., Driessen A., Nieman F., Wijnen P., Baughman R.et al. Liver-test Abnormalities in Sarcoidosis. European Journal of Gastroenterology and Hepatology. 2012;24(1):17–24. https://doi.org/10.1097/MEG.0b013e32834c7b71
- Ennaifer R., Ayadi S., Romdhane H., Cheikh M., Ben Nejma H., Bougassas W. et al. Hepatic Sarcoidosis: A Case Series. The Pan African Medical Journal. 2016;24:209. https://doi.org/10.11604/pamj.2016.24.209.7980
- Esfeh J.M., Culver D., Plesec T., John B. Clinical Presentation and Protocol for Management of Hepatic Sarcoidosis. Expert Review in Gastroenterology and Hepatology. 2015;9(3):349–358. https://doi.org/10.1586/17474124.2015.958468
- Shapovalova T.G., Kozlova I.V., Ryabova A.Yu., Arkhangelskaya E.E., Shashina M.M., Burdjuliani M.A. et al. Sarcoidosis of the Digestive System: Diagnostic and Therapeutic Aspects. Effective Pharmacotherapy. Gastroenterology. 2020;16(15):112–117. https://doi.org/10.33978/2307-3586-2020-16-15-112-117
- Kruglyakova L.V., Markova E.V., Sulima M.V. Generalized Sarcoidosis with the Affection of Digestive Organs, Urinary Tract and Lymphatic System (Clinical Observation). Amur Medical Journal. 2017:2(18):72–76. https://elibrary.ru/zdwnfv
- Nunes H., Bouvry D., Soler P., Valeyre D. Sarcoidosis. Orphanet Journal of Rare Diseases. 2007;2:46. https://doi.org/10.1186/1750-1172-2-46
- Porter N., Beynon H.L., Randeva H.S. Endocrine and Reproductive Manifestations of Sarcoidosis. Monthly Journal of the Association of Physicians. 2003;96(8):553–561. https://doi.org/10.1093/qjmed/hcg103
- Satasia M., Garg A., Weerasinghe K., Patel C., Caldararo M. Calcium Chaos in Sarcoidosis: A Tale of Severe Hypercalcemia’s Diagnostic Challenge. Cureus. 2024;16(3):e56271. https://doi.org/10.7759/cureus.56271
- Tan C.B., Rashid S., Rajan D., Gebre W., Mustacchia P. Hepatic Sarcoidosis Presenting as Portal Hypertension and Liver Cirrhosis: Case Report and Review of the Literature. Case Reports in Gastroenterology. 2012;6(1):183–189. https://doi.org/10.1159/000338355
- Graf C., Arncken J., Lange C.M., Willuweit K., Schattenberg J.M., Seessle J. et al. Hepatic Sarcoidosis: Clinical Characteristics and Outcome. JHEP Reports: Innovation in Hepatology. 2021;3(6):100360. https://doi.org/10.1016/j.jhepr.2021.100360
- Ebert E.C. Gastrointestinal and Hepatic Manifestations of Systemic Diseases. In: Geriatric Gastroenterology. Pitchumoni C., Dharmarajan T., eds. New York : Springer. 2012;623–629. https://doi.org/10.1007/978-1-4419-1623-5_67
- Shah N., Mitra A. Gastrointestinal and Hepatic Sarcoidosis: A Review Article. Clinical Liver Diseases (Hoboken). 2021;17(4):301–307. https://doi.org/10.1002/cld.1055
- Yu K.K., Liu H.Q., Zhou Z.W., Chen M.Q. Hepatic Sarcoidosis Mimicking Liver Cancer. International Journal of Clinical and Experimental Medicine. 2015;8(6):9607–9609. URL: https://clck.ru/3NFfhg
- De Boer A., van de Worp W.R.P.H., Hageman G.J., Bast A. The Effect of Dietary Components on Inflammatory Lung Diseases – A Literature Review. International Journal of Food Sciences and Nutrition. 2017;68(7):771–787. https://doi.org/10.1080/09637486.2017.1288199
- Sedki M., Fonseca N., Santiago P., Diaz L., Garcia-Buitrago M., Mirsaeidi M. et al. Hepatic Sarcoidosis: Natural History and Management Implications. Frontiers in Medicine (Lausanne). 2019;6:232. https://doi.org/10.3389/fmed.2019.00232
- Watanabe T., Jodo S. Hepatic Sarcoidosis. Canadian Medical Association Journal. 2018;190(33):E988. https://doi.org/10.1503/cmaj.180276
- Sinnanaidu R.P., Kumar V.C., Shunmugam R.H., Mahadeva S. The Clinical Management of Hepatic Sarcoidosis: A Systematic Review. JGH Open. 2024;8(6):e13076. https://doi.org/10.1002/jgh3.13076
- Moller D.R. Treatment of Sarcoidosis – from a Basic Science Point of View. Journal of Internal Medicine. 2003;253(1):31–40. https://doi.org/10.1046/j.1365-2796.2003.01075.x
- Rose A.S., Tielker M.A., Knox K.S. Hepatic, Ocular, and Cutaneous Sarcoidosis. Clinics in Chest Medicine. 2008;29(3):509–524. https://doi.org/10.1016/j.ccm.2008.03.008
- MacArthur K.L., Forouhar F., Wu G.Y. Intra-abdominal Complications of Sarcoidosis. Journal of the Formosan Medical Association. 2010;109(7):484–492. https://doi.org/10.1016/S0929-6646(10)60082-4
- Ayyala U.S., Padilla M.L. Diagnosis and Treatment of Hepatic Sarcoidosis. Current Treatment Options in Gastroenterology. 2006;9(6):475–483. https://doi.org/10.1007/s11938-006-0004-9
- Kikuchi M., Koizumi A., Namisaki T., Asada S., Oyama M., Tomooka F. et al. Improvement of Liver Histology in Hepatic Sarcoidosis due to Treatment with Corticosteroids and Ursodeoxycholic Acid: A Case Report. Clinical Journal of Gastroenterology. 2024;17(2):327–333. https://doi.org/10.1007/s12328-023-01918-3
- Peixoto J.M., Leal D., Silva D., Santos L. Löfgren Syndrome: A Case Report and Treatment Challenge. Cureus. 2024;16(5):e59597. https://doi.org/10.7759/cureus.59597
- Korsten P., Mirsaeidi M., Sweiss N.J. Nonsteroidal Therapy of Sarcoidosis. Current Opinion in Pulmonary Medicine. 2013;19(5):516–523. https://doi.org/10.1097/MCP.0b013e3283642ad0
- Bast A., Semen K.O., Drent M. Nutrition and Corticosteroids in the Treatment of Sarcoidosis. Current Opinion in Pulmonary Medicine. 2018;24(5):479–486. https://doi.org/10.1097/MCP.0000000000000501
- Gonçalves A., Simas D., Gomes P., Leal C., Atalaia-Martins C., Vasconcelos H. Navigating Challenges in a Case of Unusual Hepatic and Pulmonar Sarcoidosis: A Comprehensive Clinical Journey. Portuguese Journal of Gastroenterology. 2024;32(1):61–66. https://doi.org/10.1159/000539226
Arquivos suplementares