Взаимосвязь нарушений гемостаза и оксидативного стресса у пациентов с острым панкреатитом
- Авторы: Власов А.П.1, Аль-Кубайси Ш.С.1, Муратова Т.А.1, Мышкина Н.А.1
-
Учреждения:
- Национальный исследовательский Мордовский государственный университет
- Выпуск: Том 1, № 1 (2025)
- Страницы: 51-58
- Раздел: Патологическая физиология
- Статья получена: 16.01.2025
- Статья одобрена: 06.02.2025
- Статья опубликована: 21.03.2025
- URL: https://medbiosci.ru/MedBiotech/article/view/276992
- DOI: https://doi.org/10.15507/3034-6231.001.202501.051-058
- EDN: https://elibrary.ru/pcdvbx
- ID: 276992
Цитировать
Полный текст
Аннотация
Введение. Система гемостаза играет важную роль в утяжелении патогенетических процессов острого панкреатита и развитии осложнений, но до сих пор изучена недостаточно. Цель исследования – изучить патогенетическую взаимосвязь окислительного стресса с состоянием системы свертывания у пациентов с острым панкреатитом.
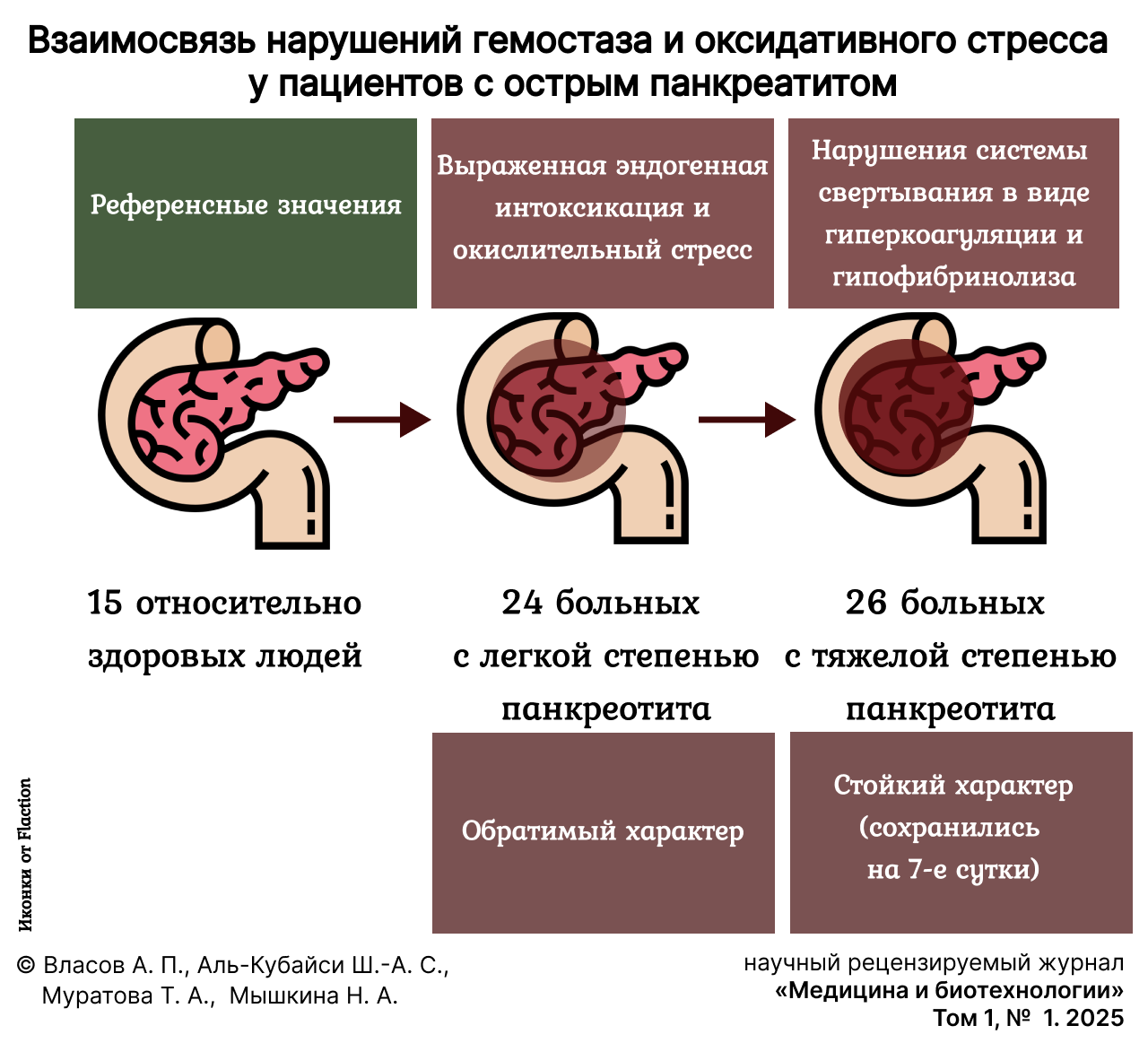
Материалы и методы. Исследовано 50 больных с острым панкреатитом, они разделены на две группы: первая (n = 24) – с легкой степенью заболевания, вторая (n = 26) – с тяжелой. С целью определения взаимосвязи нарушений гемостаза и оксидативного стресса у пациентов была проведена оценка эндотоксикоза, активности перекисного окисления липидов и функционального состояния системы гемостаза.
Результаты исследования. У изучаемых больных в раннем сроке госпитализации отмечено развитие эндогенной интоксикации (увеличение содержания индекса токсичности в плазме крови), интенсификации перекисного окисления липидов (повышение уровня диеновых конъюгатов). Анализ состояния системы свертывания выявил гиперкоагуляцию (укорочение реактивного времени) и гипофибринолиз (удлинение значения показателя лизиса сгустка).
Обсуждение и заключение. Развитие раннего окислительного стресса на фоне эндотоксикоза при остром панкреатите ведет к активации транскрипционных факторов, дисбалансу цитокиновой системы, расстройству коагуляционно-фибринолитической системы, отложению (микро)сосудистых тромбов, ишемии тканей и дисфункции органов. В присутствии окислительного стресса прогрессирует патологический процесс заболевания путем расстройства системы гемостаза, приводя к утяжелению течения заболевания. Выявленные изменения могут быть эффективны при коррекции терапии больных острым панкреатитом.
Ключевые слова
Полный текст
Введение
Острый панкреатит (ОП) – одна из наиболее распространенных патологий в хирургической практике. Частота встречаемости в структуре неотложных заболеваний органов брюшной полости составляет от 10 до 20 % [1]. Острый панкреатит является болезнью цивилизации, так как за последние два десятилетия количество пациентов увеличилось примерно в два раза [2]. В Российской Федерации данное заболевание занимает второе место среди патологий неотложной абдоминальной хирургической помощи, уступая лишь острому аппендициту [3].
Важнейшим патогенетическим процессом уже в первые часы заболевания выступает токсинемия, в которой играют роль интенсификация панкреатогенных энзимов и деструктивные изменения панкреатоцитов. Начало локального воспаления в поджелудочной железе ведет к гиперцитокинемии, характеризующейся разными патофизиологическими явлениями, такими как нарушение микроциркуляции, гистотоксическая гипоксия, коагуляционно-литический стресс. Указанные расстройства способствуют активации процессов липопереокисления в тканях органа, существенным изменениям системы свертываемости. Это может индуцировать значимые нарушения вплоть до развития синдрома системного воспалительного ответа с риском полиорганной дисфункции [4; 5]. Цель исследования – изучить патогенетическую взаимосвязь окислительного стресса с состоянием системы свертывания у пациентов с острым панкреатитом.
Материалы и методы
Работа основана на данных клинического обследования 50 больных с ОП на базе хирургических отделений Республиканской клинической больницы имени С.В. Каткова (г. Саранск) в 2024 г. Все пациенты были проинформированы о цели исследования и выразили готовность к сотрудничеству.
В зависимости от степени тяжести заболевания больные были распределены на 2 группы: первая (n = 24) – с легкой степенью ОП, вторая (n = 26) – с тяжелой.
Критерии выбора больных включали возраст – 25–65 лет, персональное согласие на участие, клинико-лабораторно-инструментальное подтверждение диагноза «острый панкреатит», женский и мужской пол, длительность ОП не более 2 суток.
В критерии исключения из исследования входили давность заболевания более 48 ч, персональный отказ, нарушение протокола исследования, оперативное лечение.
Для установления референсных значений изучаемых параметров также были обследованы 15 относительно здоровых людей.
Помимо общепринятых (клинических, лабораторных, инструментальных) методов в исследование включили специальные. Выраженность эндотоксикоза определяли по содержанию гидрофильных (молекул средней массы (МСМ)) и гидрофобных (индекса токсичности по альбумину (ИТ)) метаболитов в сыворотке крови. Оценка уровня малонового диальдегида и диеновых коньюгатов проводилась при помощи спектрофотометрического аппарата. Оптическую плотность оценивали на спектрофотометре СФ-46 при длине волны 280 нм. Состояние системы свертываемости определено тромбоэластографией TEG® 5000 (США). 1 мл крови набирали в цитратную пробирку. В кювету раскапывали 1 мл крови с 20 мкл 0,2M CaCl2, 340 мкл крови в кювету в канале 1. Определяли следующие показатели: реактивное время (мин) и показатель лизиса сгустка (%).
Степень тяжести заболевания изучаемых больных оценивалась при помощи шкалы BISAP (Bedside Index of Severity in Acute Pancreatitis) на онлайн-калькуляторе1.
Продолжительность наблюдения составила 7 суток госпитализации.
Полученные данные анализировались при помощи нескольких цифровых программ: Jamovi (2024), IBM SPSS Statistics 22, Microsoft Word и Excel 2013. Статистический расчет проводился по критериям Манна – Уитни U, Спирмена, t-Стьюдента, Кендалла, Фишера.
Результаты исследования
У пациентов группы 1 средний возраст составил 52,7 (±5,8) года (мужчин – 14 (58,4 %), женщин – 10 (41,6 %)). В группе 2 средний возраст – 55,3 (±7,1) года (мужчин – 15 (57,6 %), женщин – 11 (42,4%)).
По данным шкалы BISAP пациенты 1-й группы набрали 2,1 (±0,08) баллов, пациенты 2-й группы – 6,5 (±0,45) баллов.
Ранний срок ОП характеризовался развитием эндогенной интоксикации, выраженность которой была сопоставима со степенью тяжести болезни. Установлено, что у пациентов первой группы повышение значений показателей эндогенной интоксикации зарегистрировано на 1-е и 4-е сутки наблюдения: уровень ИТ и МСМ превышал референсные значения на 102,5 и 66,9 % (р < 0,05) и 32,1 и 20,1 % (р < 0,05) соответственно. К 7-м суткам значения этих показателей приближались к норме (рис. 1). Во второй группе уровень данных параметров был значительно выше референсного на протяжении всего периода исследования: ИТ – на 214,5–95,7 % (р < 0,05) и МСМ – 58,7–31,4 % (р < 0,05).
Рис. 1. Изменение параметров эндотоксикоза
Fig. 1. Changing of parameters of endotoxicosis
Примечание: здесь и далее * – достоверное отличие от группы нормы (р < 0,05), 1 – достоверное отличие от группы 1 (р < 0,05)
Note: here and further * – significant difference from the group norm (p < 0.05), 1 – significant difference from group 1 (p < 0.05)
Источник: здесь и далее – все рисунки составлены авторами
Source: from here on – all drawings are made by the authors
Начальный этап воспалительного процесса в поджелудочной железе у исследуемых пациентов также характеризовался активацией процессов перекисного окисления липидов (ПОЛ). У пациентов первой группы (с легкой формой ОП) концентрация диеновых конъюгатов (ДК) и малонового диальдегида (МДА) превышала референсный уровень на 1-е сутки на 98,7 и 124,2 % (р < 0,05), на 4-е – на 54,1 и 76,8 % (р < 0,05) соответственно. На финальные сутки значение этих показателей было повышено незначительно. При тяжелой степени ОП (вторая группа) содержание ДК и МДА превосходило нормальный уровень на всех этапах наблюдения: на 1-е сутки – на 197,5 и 225,7 % (р < 0,05), на 4-е сутки – на 105,4 и 157,4 % (р < 0,05), на 7-е сутки – на 74,5 и 91,3 % (р < 0,05) соответственно (рис. 2). Анализ данных тромбоэластографии выявил, что реактивное время (РВ) как показатель активности коагуляционной способности системы гемостаза было укорочено в первой группе на 1-е и 4-е сутки – на 24,5 и 19,7 % (р < 0,05). На 7-е сутки величина данного параметра вплотную приблизилась к референсному уровню.
Рис. 2. Динамика показателей липопероксидации
Fig. 2. Dynamics of indicators of lipid peroxidation
В основной группе показатель коагуляции (РВ) был понижен по сравнению с исходным значением на 1-е сутки на 41,2 % (р < 0,05), и на 4-е сутки на 26,7 % (р < 0,05). На конечном этапе реактивное время улучшилось, но оставалось ниже, чем у группы нормы, на 18,5 % (р < 0,05).
Важно отметить, что у пациентов группы сравнения уровень реактивного времени превышал уровень второй группы на всех этапах на 20,7–15,6 % (р < 0,05).
В ходе исследования обнаружено, что у пациентов с острым панкреатитом фибринолитическая активность была подвержена процессу ингибирования (рис. 3). Выявлено, что величина показателя лизиса сгустка (ПЛС), отражающего состояние фибринолиза, у пациентов с легкой степенью ОП превышала референсный уровень на 1-е сутки – на 15,7 % (р < 0,05), на 4-е сутки – на 11,7 % (р < 0,05). У больных второй группы с тяжелой формой ОП фибринолитическая депрессия была более выраженной и сохранялась на всех этапах наблюдения: значение ПЛС увеличивалось на первые сутки на 29,7 % (р < 0,05), на 4-е сутки – на 24,1 % (р < 0,05), на 7-е сутки – на 14,6 % (р < 0,05). При межгрупповом сравнении выявили, что ПЛС в группе 1 был ниже, чем во второй группе на 1-е сутки – на 15,4 % (р < 0,05), на 4-е сутки – на 13,7 % (р < 0,05), и на 7-е сутки – на 11,1 % (р < 0,05).
Рис. 3. Динамика показателей системы гемостаза
Fig. 3. Changing of parameters of hemostasis system
Согласно данным рис. 4, параметры системы свертываемости (РВ) и процессов липопереокисления (ДК) имели сильную корреляцию (р = 0,001–0,003).
Рис. 4. Частная корреляция показателей РВ и ДК по критериям Спирмена и Кендалла
Fig. 4. Partial correlation of RT and DC indicators according to Spearman and Kendall criteria
Обсуждение и заключение
По данным Федорова А. В. и соавт., легкой форме острого панкреатита соответствует 1–2 балла при оценке степени тяжести пациентов по шкале BISAP, тяжелой – 3 балла и более [6]. Полученные в исследовании результаты свидетельствуют о верном распределении пациентов по группам.
По результатам исследования активность системы гемостаза в виде гиперкоагуляции и гипофибринолиза была нарушена с ранних сроков острого панкреатита. Выраженность данных изменений ассоциировалась со степенью тяжести заболевания.
Китайские ученые считают, что развитие раннего окислительного стресса при остром панкреатите ведет к активации транскрипционных факторов, ингибированию антиоксидантной системы, дисбалансу цитокиновой системы, что вызывает гиперкоагуляцию, нарушение эндотелиально-ассоциированных антикоагулянтных процессов, ингибирование эндогенной фибринолитической системы, отложение (микро)сосудистых тромбов, ишемию тканей и дисфункцию органов [7; 8]. В ходе данного исследования выявлено, что вышеуказанные изменения системы гомеостаза, особенно активация процессов липопереокисления, регистрируемые в ранней фазе патологии, послужили причиной гемостатического дисбаланса.
Таким образом, ранний период острого панкреатита характеризуется развитием выраженной эндогенной интоксикации и окислительным стрессом. Интенсификация перекисного окисления липидов утяжеляет процессы патологического процесса заболевания путем значимых нарушений системы свертывания в виде гиперкоагуляции и гипофибринолиза. Степень последних была ассоциирована с тяжестью заболевания: у пациентов с легкой степенью ОП они носили обратимый характер, а с тяжелой степенью – стойкий (сохранились на 7-е сутки).
Полученные результаты могут быть использованы для коррекции персонализированной терапии больных острым панкреатитом.
1 https://impact.chp.gov.hk/calculator_8_1.php [Электронный ресурс].
Об авторах
Алексей Петрович Власов
Национальный исследовательский Мордовский государственный университет
Email: vap.61@yandex.ru
ORCID iD: 0000-0003-4731-2952
SPIN-код: 7405-5077
Scopus Author ID: 55543808600
ResearcherId: C-3981-2018
доктор медицинских наук, профессор, заведующий кафедрой факультетской хирургии с курсами топографической анатомии и оперативной хирургии, урологии и детской хирургии
Россия, 430005, г. Саранск, ул. Большевистская, 68Шейх-Ахмед Саад Аль-Кубайси
Национальный исследовательский Мордовский государственный университет
Автор, ответственный за переписку.
Email: shekhahmed88@yandex.ru
ORCID iD: 0000-0003-4984-2674
кандидат медицинских наук, доцент кафедры факультетской хирургии с курсами топографической анатомии и оперативной хирургии, урологии и детской хирургии
Россия, 430005, г. Саранск, ул. Большевистская, 68Татьяна Александровна Муратова
Национальный исследовательский Мордовский государственный университет
Email: tam-0811@mail.ru
ORCID iD: 0000-0001-6573-6180
SPIN-код: 3866-6985
Scopus Author ID: 57163487700
доктор медицинских наук, доцент, профессор кафедры факультетской хирургии с курсами топографической анатомии и оперативной хирургии, урологии и детской хирургии
Россия, 430005, г. Саранск, ул. Большевистская, 68Нина Алексеевна Мышкина
Национальный исследовательский Мордовский государственный университет
Email: 304ab@mail.ru
ORCID iD: 0000-0003-4622-9444
SPIN-код: 5978-7365
Scopus Author ID: 57209338336
ResearcherId: MCX-7666-2025
кандидат медицинских наук, доцент кафедры госпитальной терапии
Россия, 430005, г. Саранск, ул. Большевистская, 68Список литературы
- Ghiță A.I, Pahomeanu M.R, Negreanu L. Epidemiological Trends in Acute Pancreatitis: A Retrospective Cohort in a Tertiary Center over a Seven-Year Period. World Journal of Methodology. 2023;13(3):118–126. https://doi.org/10.5662/wjm.v13.i3.118
- Мазаник А.В. Острый панкреатит билиарной этиологии. Эпидемиология и современные представления о патогенезе. Сообщение 1. Военная медицина. 2023;2(67):102–107. https://doi.org/10.51922/2074-5044.2023.2.102
- Ревишвили А.Ш., Федоров А.В., Сажин В.П., Оловянный В.Е. Состояние экстренной хирургической помощи в Российской Федерации. Хирургия. Журнал им. Н.И. Пирогова. 2019;3:88–97. https://doi.org/10.17116/hirurgia201903188
- Власов А.П., Худайберенова Г.Д., Власова Т.И., Аль-Кубайси Ш.А.С. и др. Возможности коррекции детоксикационной и гемостазрегулирующей способности легких при остром панкреатите. Ульяновский медико-биологический журнал. 2021;2:25–35. https://doi.org/10.34014/2227-1848-2021-2-25-35
- Власов А.П., Трофимов В.А., Власова Т.И., Анаскин С.Г. и др. Респираторный дистресс-синдром при остром панкреатите (экспериментальное исследование). Анналы хирургической гепатологии. 2016;21(2):80–85. https://doi.org/10.16931/1995-5464.2016280-85
- Федоров А.В., Эктов В.Н., Ходорковский М.А. Предикторы и классификации степени тяжести острого панкреатита. Вестник хирургии имени И.И. Грекова. 2022;181(3):100–107. https://doi.org/10.24884/0042-4625-2022-181-3-100-107
- Li L., Tan Q., Wu X., Mou X., Lin Z., et al. Coagulopathy and Acute Pancreatitis: Pathophysiology and Clinical Treatment. Frontiers in Immunology. 2024;15:147–160. https://doi.org/10.3389/fimmu.2024.1477160
- Cai Y., Yang F., Huang X. Oxidative Stress and Acute Pancreatitis (Review). Biomedical Reports. 2024;21(2):124. https://doi.org/10.3892/br.2024.1812
Дополнительные файлы