Гиперэозинофильный синдром: современные подходы к молекулярно-генетической диагностике и терапии генно-инженерными биологическими препаратами
- Авторы: Балыкова Л.А.1, Краснопольская А.В.1, Ширманкина М.В.1, Мендес Д.А.1, Ханина А.М.1
-
Учреждения:
- Национальный исследовательский Мордовский государственный университет
- Выпуск: Том 1, № 1 (2025)
- Страницы: 13-23
- Раздел: Внутренние болезни
- Статья получена: 01.02.2025
- Статья одобрена: 17.02.2025
- Статья опубликована: 21.03.2025
- URL: https://medbiosci.ru/MedBiotech/article/view/278717
- DOI: https://doi.org/10.15507/3034-6231.001.202501.013-023
- EDN: https://elibrary.ru/yiswie
- ID: 278717
Цитировать
Полный текст
Аннотация
Введение. В последние годы возрастает интерес исследователей к состояниям, сопровождающимся гиперэозинофилией, и возможностям терапии с применением генно-инженерных биологических препаратов. Гиперэозинофильный синдром является недостаточно изученной проблемой, которая охватывает ряд заболеваний, характеризующихся персистирующей эозинофилией с эозинофильным поражением внутренних органов. Цель исследования – систематизация данных научной литературы о новых методах диагностики и лечения гиперэозинофильного синдрома.
Материалы и методы. Проведен анализ научных работ, отобранных по ключевым словам «гиперэозинофилия», «гиперэозинофильный синдром», «молекулярно-генетические исследования», «идиопатический гиперэозинофильный синдром», «моноклональное антитело» из когорты полнотекстовых публикаций, представленных в научных электронных библиотеках eLibrary, PubMed, Scopus в 2005–2024 гг.
Результаты исследования. Гиперэозинофильный синдром является редким состоянием, в литературе представлено ограниченное количество научных наблюдений, в основном анализ отдельных клинических случаев. Крайне лимитированы данные о распространенности гиперэозинофильного синдрома в детской популяции. Причины синдрома вариабельны, а клиническая картина полиморфна, что осложняет путь к постановке диагноза. Решению проблемы способствует проведение молекулярно-генетического исследования с детекцией типа мутаций генов тирозинкиназы. В терапии препаратами первой линии являются глюкокортикостероиды. Показано, что более эффективными средствами лечения первичного гиперэозинофильного синдрома являются генно-инженерные биологические препараты, с патогенетически обоснованным применением которых связывают прогресс терапии.
Обсуждение и заключение. Гиперэозинофильный синдром чаще встречается у пациентов молодого и среднего возраста. Диагностические критерии включают устойчивую гиперэозинофилию с повреждением / дисфункцией органов и исключение других миелоидных новообразований. Применение генно-инженерных биологических препаратов позволяет преодолеть рефрактерность, снизить потребность в глюкокортикостероидах и предупредить развитие лекарственных осложнений.
Полный текст
Введение
Эозинофилы – это тип специализированных миелоидных клеток (эозинофильных гранулоцитов) в периферической крови, которые происходят из мультипотентных гемопоэтических стволовых клеток. Развитие, миграция и функция эозинофилов жестко регулируются сетями факторов транскрипции, факторов роста, цитокинов и хемокинов. У здоровых людей количество эозинофилов в периферической крови колеблется от 0,05 до 0,5×109/л (50–500/мкл). Эозинофилы дифференцируются из миелоидных предшественников в костном мозге под контролем гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF), интерлейкина IL-3 и IL-5 – цитокинов, действующих как факторы роста и ингибиторы апоптоза [1].
Термин «гиперэозинофильный синдром» был предложен для объединения патологий с рядом тесно связанных расстройств, характеризующихся хронически повышенным уровнем эозинофилов в периферической крови и повреждением органов, связанным с эозинофильной инфильтрацией [2]. Позднее «идиопатический» гиперэозинофильный синдром (ГЭС) определили как устойчивую эозинофилию периферической крови неизвестного происхождения, превышающую 1,5×109/л в течение более 6 последовательных месяцев и ответственную за развитие дисфункции и/или повреждения органов [3]. В настоящее время термин «идиопатический» используется исключительно при ГЭС с неизвестной этиологией, а термин «гиперэозинофильный синдром(ы)» – для охвата гетерогенной группы заболеваний с выраженной гиперэозинофилией и эозинофильной инфильтрацией тканей, включая варианты ГЭС с хорошо охарактеризованными патогенными механизмами, семейный ГЭС и органоспецифическое эозинофильно-опосредованное заболевание (эозинофильный гастроэнтерит, эозинофильная пневмония и др.) [4].
Цель исследования – систематизировать данные научной литературы о новых методах диагностики и лечения гиперэозинофильного синдрома.
Материалы и методы
Проведен анализ научных работ, отобранных по ключевым словам «гиперэозинофилия», «гиперэозинофильный синдром», «молекулярно-генетические исследования», «идиопатический гиперэозинофильный синдром», «моноклональное антитело» из когорты полнотекстовых публикаций, представленных в научных электронных библиотеках eLibrary, PubMed, Scopus в 2005–2024 гг. Обзор литературных источников осуществлялся по классической схеме описания заболевания: определение, эпидемиология, классификация, патогенез, клиническая картина, диагностика и лечение. Особое внимание было уделено комплексу диагностических мероприятий и стратегии терапии ГЭС.
Результаты исследования
Эпидемиология ГЭС. ГЭС чаще диагностируют в молодом и среднем возрасте, имеются свидетельства доминирования мужчин среди заболевших [3]. Распространенность достоверно неизвестна. За период с 2004 по 2015 гг. показатель заболеваемости ГЭС составил 0,4 случая на 100 тыс. чел. [5].
Классификация ГЭС была пересмотрена Всемирной организацией здравоохранения (ВОЗ) в 2008 г., подтверждена в 2016 и 2022 гг. [6; 7]. Вследствие расширения списка молекулярно-генетически определенных первичных эозинофилий, возникающих в результате изменения генов тирозинкиназы, и для уточнения молекулярно-генетических изменений, приводящих к этим новообразованиям, основная категория «Миелоидные / лимфоидные новообразования с эозинофилией и перестройкой PDGFRA, PDGFRB или FGFR1 или с PCM1-JAK2» была переименована в «Миелоидные / лимфоидные новообразования с эозинофилией и слиянием генов тирозинкиназы» (MLN-eo-TK) [8; 9]. Диагностическими критериями этой группы заболеваний являются миелоидное и/или лимфоидное новообразование, обычно с выраженной эозинофилией, а иногда с нейтрофилией или моноцитозом и одним из следующих признаков:
- Наличие гена слияния FIP1L1::PDGFRA (или вариантного гена слияния, включающего PDGFRA в хромосомной области 4q12);
- Наличие транслокации в области 35q32, вовлекающей ген PDGFRB;
- Наличие транслокации в области 8q11, вовлекающей ген FGFR1;
- Наличие транслокации в области 9p24, вовлекающей ген JAK2;
- Наличие транслокации в области 13q12, вовлекающей ген FLT3;
- Наличие t(9;12)(q34.1;p13.2) в гене слияния ETV6::ABL1;
- Наличие других определенных генов слияния тирозинкиназы, таких как ETV6::FGFR2; ETV6::LYN; ETV6::NTRK3; RANBP2::ALK; BCR::RET; FGFR1OP::RET [10; 11] (таблица).
Таблица. Классификация гиперэозинофильного синдрома
Table. Classification of hypereosinophilic syndrome
Нозологическая форма / Nosological form | Диагностические критерии / Diagnostic criteria |
Миелоидные / лимфоидные новообразования с эозинофилией и генами слияния тирозинкиназы / Myeloid / lymphoid neoplasms with eosinophilia and tyrosine kinase fusion genes | 1. Устойчивая гиперэозинофилия (количество эозинофилов ≥ 1,5×109/л) / Persistent hypereosinophilia (eosinophil count ≥ 1.5×109/l) 2. Повреждение / дисфункция органов, обусловленная эозинофилией / инфильтрацией тканей эозинофилами / Organ damage /dysfunction due to eosinophilia / tissue infiltration by eosinophils 3. Исключение реактивной эозинофилии, лимфоцитарного варианта гиперэозинофильных синдромов, других миелоидных новообразований / Exclusion of reactive eosinophilia, lymphocytic variant of hypereosinophilic syndromes, other myeloid neoplasms |
Хронический эозинофильный лейкоз / Chronic eosinophilic leukemia | |
Идиопатический гиперэозинофильный синдром / Idiopathic hypereosinophilic syndrome |
Источник: составлено авторами статьи по материалам [9–11].
Source: compiled by the authors of the article based on the materials [9–11].
Хронический эозинофильный лейкоз (ХЭЛ) определяется отсутствием филадельфийской хромосомы и перестроек, наблюдаемых при MLN-eo-TK, исключением других острых или хронических первичных новообразований костного мозга, связанных с эозинофилией, таких как острый миелоидный лейкоз, миелодиспластический синдром, системный мастоцитоз, классические миелопролиферативные новообразования, и перекрестных расстройств [10]. Диагностическими критериями ХЭЛ являются:
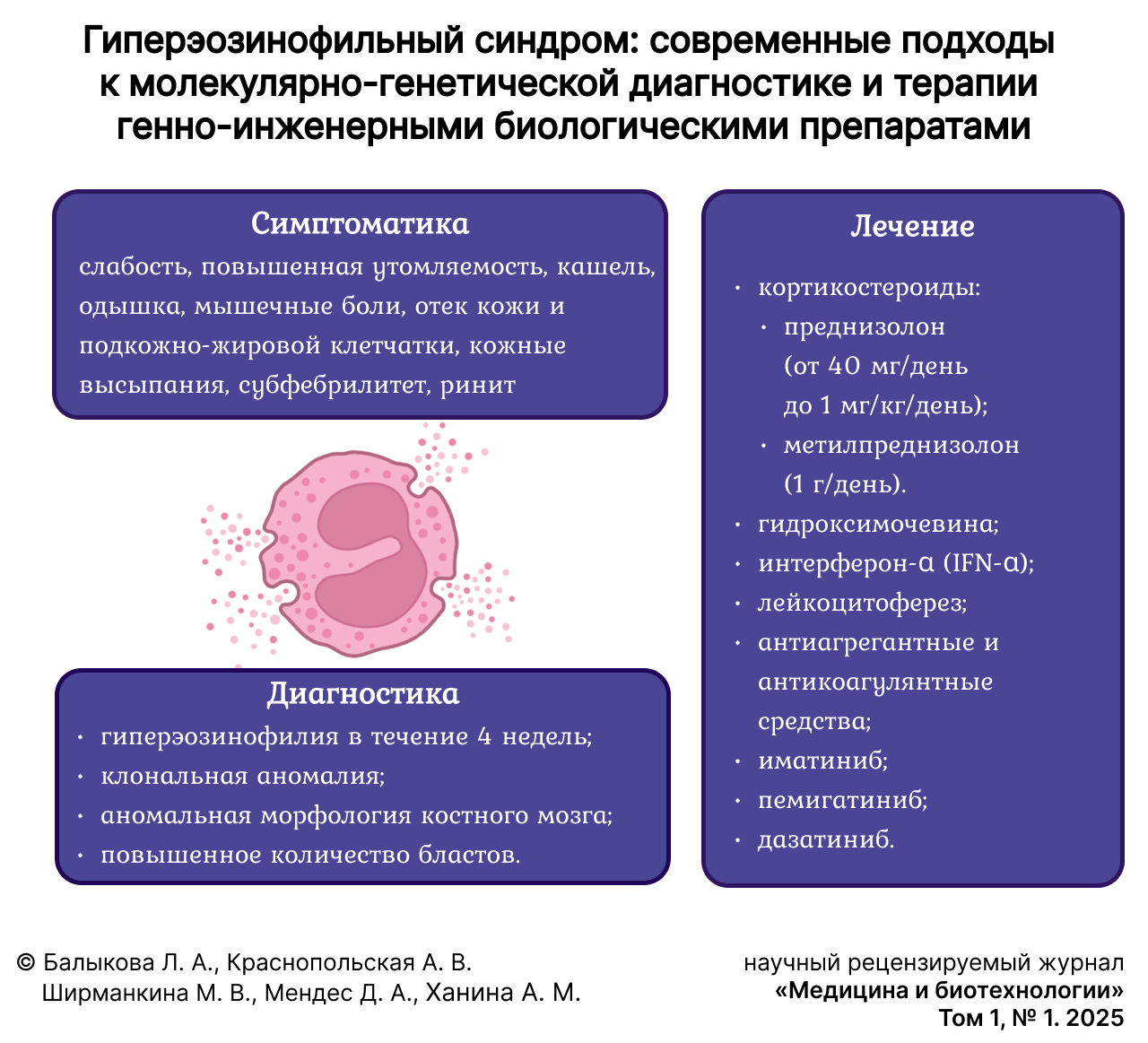
- Устойчивая гиперэозинофилия (эозинофилы ≥ 1,5×109/л и ≥ 10 %) в течение 4 недель;
- Наличие клональной аномалии (по цитогенетике и/или соматической мутации по NGS);
- Аномальная морфология костного мозга (мегакариоцитарная и/или эритроидная дисплазия) или наличие повышенного количества бластов (≥ 5 % в костном мозге и/или ≥ 2 % в периферической крови, но < 20 % в периферической крови и костном мозге);
- Несоответствие критериям ВОЗ для другого миелоидного новообразования [10; 11].
Пороговое значение количества эозинофилов – 1,5×109/л – является обсуждаемым, поскольку у некоторых пациентов может наблюдаться значительное поражение тканей и органов-мишеней при их меньшем количестве [7; 11].
Патогенетические механизмы ГЭС. Воспалительный процесс с повреждением органов развивается в результате экскреции эозинофильными гранулоцитами цитотоксических соединений и энзимов: главного основного протеина, коллагеназы, нейротоксина, свободных кислородных радикалов, рибонуклеазы, эластазы, эозинофильного катионного белка, пероксидазы [1; 12]. Помимо перечисленного перечня медиаторов продукция лейкотриенов и простагландинов эозинофилами изменяет гладкомышечный тонус сосудов и бронхов, усугубляя патологический процесс. В свою очередь, секреция провоспалительных цитокинов способствует дисрегуляции иммунного ответа и ремоделированию тканей, в частности увеличению коллагенообразования под действием трансформирующего фактора роста-β [3].
Клиническая картина ГЭС. Выраженность симптомов варьируется и определяется инфильтрацией эозинофильными гранулоцитами органов-мишеней, чаще поражаются кожа, легкие, нервная система и сердце [3; 12; 13].
Наиболее распространенными являются неспецифические клинические признаки: слабость, повышенная утомляемость, кашель, одышка, мышечные боли, отек кожи и подкожно-жировой клетчатки, кожные высыпания, субфебрилитет, ринит [14].
Дерматологические проявления зарегистрированы у 69 % пациентов, за которыми по частоте следуют признаки легочных, неврологических и желудочно-кишечных поражений. Кожные проявления (40–70 %) распространены и неспецифичны, обычно состоят либо из ангиоэдематозных симптомов и элементов крапивницы, либо из эритематозных, зудящих папул и узелков, напоминающих экзему. Возможно появление язв на слизистых оболочках [15].
Нарушения неврологического статуса отмечаются в 5–20 % случаев и развиваются по типу либо диффузной энцефалопатии, либо периферической полинейропатии. При первом варианте наблюдаются изменения поведения и когнитивных функций, спутанность сознания, потеря памяти. При втором варианте беспокоят симметричные или асимметричные сенсорные изменения, двигательные расстройства [16; 17].
Поражение бронхолегочной системы при ГЭС определяется в 25–40 % случаев, проявления могут варьироваться от постоянного сухого кашля и/или гиперреактивности бронхов при отсутствии рентгенологических отклонений до рестриктивного поражения с легочными инфильтратами и фиброзом [3; 18]. В литературе имеются редкие описания клинических случаев с развитием острого респираторного дистресс-синдрома [3].
Поражения желудочно-кишечного тракта при ГЭС развиваются в 15–35 % случаев по типу эозинофильного гастрита, энтероколита или колита, проявляются болью в животе, тошнотой, рвотой, диареей. При тотальной инфильтрации эозинофилами стенок кишечника регистрируются признаки асцита [19].
Сердечно-сосудистые заболевания, не связанные с гипертонией, атеросклерозом или ревматической патологией, выявлены у 5–20 % пациентов с ГЭС (только у 6 % на момент первоначального обращения) [20]. Прогрессирующая сердечная недостаточность является прототипическим примером поражения органов, опосредованного эозинофилами. Она включает многоступенчатый патофизиологический процесс с эозинофильной инфильтрацией сердечной ткани и высвобождением цитотоксичных медиаторов. Повреждение эндокарда с образованием тромбоцитарного тромба может привести к появлению пристеночных тромбов и повышению риска эмболии. Фиброзное утолщение эндокардиальной оболочки на поздней стадии фиброза может перерасти в рестриктивную кардиомиопатию [21]. Клапанная недостаточность возникает в результате пристеночного эндокардиального тромбоза и фиброза, затрагивающего створки митрального или трехстворчатого клапанов [22; 23].
Диагностика ГЭС. При работе с больным гиперэозинофилией врач должен прежде всего ответить на два вопроса: 1) является ли гиперэозинофилия вторичным заболеванием по отношению к распространенному и поддающемуся лечению фоновому заболеванию, такому как паразитарные инфекции или побочные реакции на лекарственные препараты? 2) вызывает ли гиперэозинофилия сама по себе быстро прогрессирующее повреждение [24]?
В большинстве случаев ГЭС являются реактивными за счет гиперпродукции эозинофилопоэтических цитокинов (IL-3, IL-5, GM-CSF) и чаще связаны с атопическими, аллергическими состояниями, инфекциями, применением лекарственных средств, аутоиммунными и соединительнотканными заболеваниями или, реже, гематологическими или солидными опухолями, при которых эозинофилии являются доброкачественными (паранеопластическое увеличение). Требуется сбор подробного анамнеза и диагностическое обследование для исключения реактивного ГЭС [25].
Во всех случаях рекомендуются следующие исследования: общий анализ крови, мазок периферической крови на диспластические эозинофилы или бластные клетки, оценка уровня сывороточной триптазы (повышение – при системном мастоцитозе, иногда при других миелоидных заболеваниях), сывороточного витамина B12 (повышение – при миелоидных новообразованиях), иммуноглобулина E и сердечного тропонина, антинейтрофильных цитоплазматических и антинуклеарных антител, антител к циклическому цитруллинированному пептиду, С-реактивного протеина, ревматоидного фактора, натрийуретического пропептида, субпопуляционного состава лимфоцитов, компонентов (С) системы комплемента (C3, C4, ингибитора C1q), исследование на гельминтозы (антитела + исследование кала), фиброэзофагогастродуоденоскопия, колоноскопия, электро- и эхокардиограмма, тесты функции легких и компьютерная томография, цитогенетика костного мозга, молекулярно-генетические исследования генов слияния тирозинкиназы, гистологическое исследование (часто не дает окончательных результатов), анализ методом флуоресцентной гибридизации in situ (FISH) для гена слияния FIP1L1::PDGFRA [26–28].
Эти исследования могут быть ценными для выявления и оценки тяжести поражения органов, опосредованного эозинофилами. Потенциальные осложнения, связанные с инфильтрацией тканей и органов, идентичны независимо от повышения эозинофилов по отношению к идентифицируемому заболеванию. Наиболее серьезными осложнениями гиперэозинофилии, требующими срочных мер по снижению уровня эозинофилов, являются повреждение миокарда, поражение легких с гипоксией и неврологическое поражение [3; 23].
При ГЭС лейкоцитоз (например, 20–30×109/л или выше) с периферической эозинофилией в диапазоне 30–70 % является обычным явлением [19]. В костном мозге могут быть выявлены кристаллы Шарко – Лейдена, содержащие эозинофильный белок галектин-10, иногда – повышенное количество бластов и фиброз костного мозга [15; 25; 26].
Лечение ГЭС. Кортикостероиды являются вариантом первой линии для пациентов с идиопатическим ГЭС [19]. Рекомендуемая дозировка для взрослых составляет от 40 мг/день до 1 мг/кг/день преднизолона перорально; в более тяжелых случаях следует использовать 1 г метилпреднизолона в день. У детей с ГЭС доза метилпреднизолона 2 мг/кг/день может использоваться в качестве лечения первой линии. Обычно наблюдается быстрое снижение эозинофилии крови, однако постепенное снижение дозы кортикостероидов обычно необходимо продлить на несколько месяцев (медианная поддерживающая доза 10 мг/день) [29].
Гидроксимочевина может использоваться в сочетании с кортикостероидами или в качестве монотерапии у неответчиков. Препарат эффективно контролирует количество лейкоцитов и эозинофилов, но нет достаточных доказательств влияния на течение ГЭС [30].
Вариантом второй линии для пациентов, которые не реагируют или не переносят кортикостероиды и гидроксимочевину, является интерферон-α (IFN-α). IFN-α может вызывать гематологическую или цитогенетическую ремиссию, а также обратимость повреждения органов. У пациентов с агрессивным заболеванием была предпринята попытка аллогенной трансплантации гемопоэтических стволовых клеток костного мозга / периферической крови с различными результатами [25]. Лейкоцитоферез может вызывать временное снижение высокого количества лейкоцитов и эозинофилов, но неэффективен в долгосрочной перспективе [25; 26]. Антиагрегантные и антикоагулянтные средства могут быть полезны для профилактики тромбоэмболии; однако стандартный подход, регулирующий их использование в качестве первичной профилактики у пациентов с ГЭС, в настоящее время отсутствует [14; 19].
Другие иммунодепрессанты, такие как циклоспорин, азатиоприн и метотрексат, могут использоваться у пациентов с ГЭС для контроля заболевания и в качестве стероидсберегающих препаратов [30].
Иматиниб является эффективным средством лечения пациентов с ГЭС, вызванным эозинофильным новообразованием с перестройкой PDGFRA/B [12]. Заболевания у пациентов с ГЭ и перестроенным клональным маркером FIP1L1-PDGFRA относятся к категории «миелоидные / лимфоидные новообразования с эозинофилией и слиянием генов тирозинкиназы» и, как правило, дают хороший ответ на терапию иматинибом [31–33].
Пемигатиниб как ингибитор Fibroblast Growth Factor Receptor 1 (FGFR1) был недавно одобрен для лечения пациентов с миелоидными / лимфоидными новообразованиями с перестройкой FGFR1 [34]. Ингибитор JAK1/JAK2 руксолитиниб в настоящее время изучается при ГЭС и первичных эозинофильных расстройствах [35]. Дазатиниб, противоонкологический препарат, разработанный для блокирования функции BCR-ABL, недавно был изучен при нескольких миелопролиферативных заболеваниях, включая ГЭС1.
Хотя у большинства пациентов с ГЭС наблюдается высокая начальная скорость ответа на кортикостероиды, многие становятся рефрактерными или развивают побочные эффекты, связанные с длительным применением этих препаратов. Объяснением может служить наблюдающаяся у больных гиперцитокинемия, при этом известно, что IL-5 играет ключевую роль в содействии дифференцировке, активации и выживанию эозинофилов [11]. Поэтому моноклональные антитела, нацеленные на этот иммуномедиатор, вызывают все больший интерес к лечению ГЭС. Среди них меполизумаб, который блокирует связывание IL-5 с α-цепью специфичного рецептора на эозинофилах и рекомендуется «в качестве дополнительного лечения для взрослых пациентов с недостаточно контролируемым гиперэозинофильным синдромом без идентифицируемой негематологической вторичной причины» в дозе 300 мг/4 недели [36–38].
Разработан ряд других препаратов гуманизированных моноклональных антител, эффективность которых при терапии ГЭС активно исследуется. Так, реслизумаб, соединяясь с циркулирующим IL-5, предотвращает его связывание с IL-5R на эозинофилах. Данные о его использовании у пациентов с ГЭС ограничены отдельными сообщениями о случаях и небольшим исследованием фазы 2 [39; 40].
Другие антитела против IL-5 (депемокимаб) или рецептора IL-5 (бенрализумаб) также показали многообещающие результаты при клинических испытаниях. В настоящее время продолжается рандомизированное двойное слепое плацебо-контролируемое исследование по изучению эффективности и безопасности депемокимаба у взрослых с неконтролируемым ГЭС. Цель состоит в уменьшении «вспышек» ухудшения клинических симптомов и увеличения количества эозинофилов с повышенной потребностью в системных кортикостероидах или других иммунодепрессантах. Опыт показал, что при ГЭС редко можно полностью прекратить прием кортикостероидов, и большинству пациентов требуется базовая терапия кортикостероидами в низких дозах для контроля активности заболевания, несмотря на добавление иммунодепрессантов и/или биологических препаратов2.
Бенрализумаб – гуманизированное моноклональное антитело, нацеленное на α-субъединицу IL-5R, продемонстрировал свою эффективность у пациентов с ГЭС, не поддающихся лечению и имеющих отрицательный PDGFRA, в двойном слепом плацебо-контролируемом исследовании фазы 2 [41] и в отчетах об отдельных случаях [42–44].
Если диагностирован ГЭС, системный подход на основе стероидов является обязательным для того, чтобы вызвать ремиссию острой фазы и/или предотвратить или ограничить необратимое повреждение органов в хронической фазе, даже в случае поражения конкретных органов [30; 45]. Однако сочетание стероидной терапии с более органно-ориентированной терапией может быть полезным для поддержки определенных функций органов или устранения последствий их нарушения, связанных с их повреждением. Например, если возникает сердечная недостаточность, рекомендуется использовать традиционные стратегии, включая антигипертензивные препараты, диуретики, бета-блокаторы или другие в соответствии с текущим клиническим профилем [46; 47].
Обсуждение и заключение
Гиперэозинофильный синдром объединяет гетерогенную группу заболеваний с выраженной гиперэозинофилией и эозинофильной инфильтрацией тканей, чаще встречается у пациентов молодого и среднего возраста. Клинические симптомы имеют преимущественно неспецифический характер, выраженность их варьируется и определяется поражением органов-мишеней [3; 4; 13].
Диагностические критерии включают устойчивую гиперэозинофилию с повреждением / дисфункцией органов и исключение других миелоидных новообразований. Расширен список молекулярно-генетически определенных первичных эозинофилий, возникающих в результате изменения генов тирозинкиназы [10; 11].
Глюкокортикостероиды являются вариантом первой линии для пациентов с идиопатическим ГЭС [29]. Разработан ряд препаратов гуманизированных моноклональных антител, эффективность которых при терапии ГЭС активно исследуется [38–40]. Применение ГИБП направлено на преодоление рефрактерности, снижение нуждаемости в глюкокортикостероидах, профилактику лекарственных осложнений.
1 Дазатиниб в качестве терапии миелопролиферативных заболеваний (MPDs) [Электронный ресурс] // Good Clinical Practice Network : офиц. сайт. URL: https://clck.ru/3GAdT4 (дата обращения: 20.01.2025).
2 Депемокимаб у участников с гиперэозинофильным синдромом, исследование эффективности и безопасности (DESTINY) [Электронный ресурс] // Good Clinical Practice Network : офиц. сайт. URL: https://ichgcp.net/ru/clinical-trials-registry/NCT05334368 (дата обращения: 20.01.2025).
Об авторах
Лариса Александровна Балыкова
Национальный исследовательский Мордовский государственный университет
Email: larisabalykova@yandex.ru
ORCID iD: 0000-0002-2290-0013
SPIN-код: 2024-5807
Scopus Author ID: 6602093133
ResearcherId: AAH-8091-2019
доктор медицинских наук, профессор, член-корреспондент
РАН, проректор по инновационной деятельности в сфере биотехнологии и медицины
Анна Валерьевна Краснопольская
Национальный исследовательский Мордовский государственный университет
Автор, ответственный за переписку.
Email: akrasnopolskaja@gmail.com
ORCID iD: 0000-0003-3990-9353
SPIN-код: 6033-5816
Scopus Author ID: 57201019390
кандидат медицинских наук, доцент кафедры педиатрии
с курсом диетологии
Марина Васильевна Ширманкина
Национальный исследовательский Мордовский государственный университет
Email: shirmankina99@mail.ru
ORCID iD: 0000-0002-9049-5662
SPIN-код: 2141-2903
ассистент кафедры педиатрии с курсом диетологии
Россия, 430005, г. Саранск, ул. Большевистская, 68Дива Аугушта Тавареш Мендес
Национальный исследовательский Мордовский государственный университет
Email: dyvmendes@gmail.com
ORCID iD: 0009-0008-1526-2827
аспирант кафедры педиатрии с курсом диетологии
Россия, 430005, г. Саранск, ул. Большевистская, 68Анастасия Михайловна Ханина
Национальный исследовательский Мордовский государственный университет
Email: anastas.khanina@gmail.com
ORCID iD: 0009-0000-0160-0532
студент Медицинского института
Россия, 430005, г. Саранск, ул. Большевистская, 68Список литературы
- Rothenberg M.E., Hogan S.P. The Eosinophil. Annual Review of Immunology. 2006;24:147–174. https://doi.org/10.1146/annurev.immunol.24.021605.090720
- Tzankov A., Reichard K.K., Hasserjian R.P., et al. Updates on Eosinophilic Disorders. Virchows Archive: An International Journal of Pathology. 2023;482(1):85–97. https://doi.org/10.1007/s00428-022-03402-8
- Roufosse F.E., Goldman M., Cogan E. Hypereosinophilic Syndromes. Orphanet Journal of Rare Diseases. 2007;2:37. https://doi.org/10.1186/1750-1172-2-37
- Kelemen K., Saft L., Craig F.E., Orazi, A., et al. Eosinophilia / Hypereosinophilia in the Setting of Reactive and Idiopathic Causes, Well-Defined Myeloid or Lymphoid Leukemias, or Germline Disorders. American Journal of Clinical Pathology. 2021;155(2):179–210. https://doi.org/10.1093/ajcp/aqaa244
- Ruan G.J., Smith C.J., Day C., et al. A Population-Based Study of Chronic Eosinophilic Leukemia – Not Otherwise Specified in the United States. American Journal of Hematology. 2020;95(10):E257–E260. https://doi.org/10.1002/ajh.25906
- Arber D.A., Orazi A., Hasserjian R., et al. The 2016 Revision to the World Health Organization Classification of Myeloid Neoplasms and Acute Leukemia. Blood. 2016;127(20):2391-2405. https://doi.org/10.1182/blood-2016-03-643544
- Khoury J.D., Solary E., Abla O., et al. The 5th Edition of the World Health Organization Classification of Haematolymphoid Tumours: Myeloid and Histiocytic / Dendritic Neoplasms. Leukemia. 2022;36(7):1703–1719. https://doi.org/10.1038/s41375-022-01613-1
- Bruford E.A., Antonescu C.R., Carroll A.J., Chinnaiyan A., et al. HUGO Gene Nomenclature Committee (HGNC) Recommendations for the Designation of Gene Fusions. Leukemia. 2021;35(6):3040–3043. https://doi.org/10.1038/s41375-021-01436-6
- Alaggio R., Amador C., Anagnostopoulos I., et al. The 5th Edition of the World Health Organization Classification of Haematolymphoid Tumours: Lymphoid Neoplasms. Leukemia. 2022;36(7):1720–1748. https://doi.org/10.1038/s41375-022-01620-2
- Valent P., Klion A.D., Roufosse F., Simon D., et al. Proposed Refined Diagnostic Criteria and Classification of Eosinophil Disorders and Related Syndromes. Allergy. 2022:78(1):47–59. https://doi.org/10.1111/all.15544
- Shomali W., Gotlib J. World Health Organization and International Consensus Classification of Eosinophilic Disorders: 2024 Update on Diagnosis, Risk Stratification, and Management. American Journal of Hematology. 2024;99(5):946–968. https://doi.org/10.1002/ajh.27287
- Akuthota P., Weller P.F. Spectrum of Eosinophilic End-Organ Manifestations. Immunology and Allergy Clinics in North America. 2015;35(3):403–411. https://doi.org/10.1016/j.iac.2015.04.002
- Сторожаков Г.И. Поражение сердца при гиперэозинофильном синдроме. Сердечная недостаточность. 2008;9(3):150–153. EDN: JXGZVZ
- Requena G., Bosch J., Akuthota P., Kovalszki A., Steinfeld J., et al. Clinical Profile and Treatment in Hypereosinophilic Syndrome Variants: A Pragmatic Review. The Journal of Allergy and Clinical Immunology. In Practice. 2022;10(8):2125–2134. https://doi.org/10.1016/j.jaip.2022.03.034
- Fletcher S., Bain B. Diagnosis and Treatment of Hypereosinophilic Syndromes. Current Opinion in Hematology. 2007;14(1):37–42. https://doi.org/10.1097/00062752-200701000-00008
- Chen H., Raza H.K., Jing J., et al. Hypereosinophilic Syndrome with Central Nervous System Involvement: Two Case Reports and Literature Review. Brain Injury. 2017;31(12):1695–1700. https://doi.org/10.1080/02699052.2017.1357835
- Barbind K.L., Boddu R., Shijith K.P., Mishra K. Hypereosinophilia: A Rare Cause of Stroke and Multiorgan Dysfunction. BMJ Case Reports. 2021;14(10):e242619. https://doi.org/10.1136/bcr-2021-242619
- Mormile M., Mormile I., Fuschillo S., et al. Eosinophilic Airway Diseases: From Pathophysiological Mechanisms to Clinical Practice. International Journal of Molecular Sciences. 2023;24(8):7254. https://doi.org/10.3390/ijms24087254
- Ogbogu P.U., Bochner B.S., Butterfield J.H., et al. Hypereosinophilic Syndrome: a Multicenter, Retrospective Analysis of Clinical Characteristics and Response to Therapy. The Journal of Allergy and Clinical Immunology. 2009;124(6):1319–1325. https://doi.org/10.1016/j.jaci.2009.09.022
- Kuang F.L., Curtin B.F., Alao H., et al. Single-Organ and Multisystem Hypereosinophilic Syndrome Patients with Gastrointestinal Manifestations Share Common Characteristics. The Journal of Allergy and Clinical Immunology. In Practice. 2020;8(8):2718–2726. https://doi.org/10.1016/j.jaip.2020.04.025
- Bondue A., Carpentier C., Roufosse F. Hypereosinophilic Syndrome: Considerations for the Cardiologist. Heart (British Cardiac Society). 2022;108(3):164–171. https://doi.org/10.1136/heartjnl-2020-317202
- Hwang J.W., Kim H., Cho S.W., et al. Idiopathic Hypereosinophilic Syndrome with Intracardiac Atypical Linear-Shaped and Floating Thrombus Presenting as Embolic Cerebral Infarction. Journal of Cardiology Cases. 2020;23(5):193–197. https://doi.org/10.1016/j.jccase.2020.10.015
- Ryan D., Inamullah O., El Husseini N., et al. The Hypereosinophilic Syndrome – An Unusual Cause of Myocarditis and Cardioembolic Strokes. The American Journal of the Medical Sciences. 2022;364(5):661–668. https://doi.org/10.1016/j.amjms.2022.05.019
- Thomsen G.N., Christoffersen M.N., Lindegaard H.M., et al. The Multidisciplinary Approach to Eosinophilia. Frontiers in Oncology. 2023;13:1193730. https://doi.org/10.3389/fonc.2023.1193730
- Shomali W., Gotlib J. World Health Organization-Defined Eosinophilic Disorders: 2022 Update on Diagnosis, Risk Stratification, and Management. American Journal of Hematology. 2022;97(1):129–148. https://doi.org/10.1002/ajh.26352
- Schwaab J., Lübke J., Reiter A., et al. Idiopathic Hypereosinophilic Syndrome – Diagnosis and Treatment. Allergo Journal International. 2022;31:251–256. https://doi.org/10.1007/s40629-022-00221-w
- Carpentier C., Schandene L., Dewispelaere L., et al. CD3−CD4+ Lymphocytic Variant Hypereosinophilic Syndrome: Diagnostic Tools Revisited. The Journal of Allergy and Clinical Immunology. In Practice. 2021;9(6):2426–2439. https://doi.org/10.1016/j.jaip.2021.01.030
- Snider J.S., Znoyko I., Lindsey K.G., et al. Integrated Genomic Analysis Using Chromosomal Microarray, Fluorescence in situ Hybridization and Mate Pair Analyses: Characterization of a Cryptic t(9;22)(p24.1;q11.2)/ BCR-JAK2 in Myeloid / Lymphoid Neoplasm with Eosinophilia. Cancer Genetics. 2020;246–247:44–47. https://doi.org/10.1016/j.cancergen.2020.08.004
- Groh M., Rohmer J., Etienne N., et al. French Guidelines for the Etiological Workup of Eosinophilia and the Management of Hypereosinophilic Syndromes. Orphanet Journal of Rare Diseases. 2023;18(1):100. https://doi.org/10.1186/s13023-023-02696-4
- Hwee J., Huynh L., Du S., et al. Hypereosinophilic Syndrome in Europe: Retrospective Study of Treatment Patterns, Clinical Manifestations, and Healthcare Resource Utilization. Annals of Allergy, Asthma and Immunology. 2023;130(6):768–775. https://doi.org/10.1016/j.anai.2023.02.022
- David M., Cross N.C., Burgstaller S., et al. Durable Responses to Imatinib in Patients with PDGFRB Fusion Gene-Positive and BCR-ABL-Negative Chronic Myeloproliferative Disorders. Blood. 2007;109(1):61–64.https://doi.org/10.1182/blood-2006-05-024828
- Garcia-Gutierrez V., Hernandez-Boluda J.C. Tyrosine Kinase Inhibitors Available for Chronic Myeloid Leukemia: Efficacy and Safety. Frontiers in Oncology. 2019;9:603. https://doi.org/10.3389/fonc.2019.00603
- Schwaab J., Naumann N., Luebke J., et al. Response to Tyrosine Kinase Inhibitors in Myeloid Neoplasms Associated with PCM1-JAK2, BCR-JAK2 and ETV6-ABL1 Fusion Genes. American Journal of Hematology. 2020;95(7):824–833. https://doi.org/10.1002/ajh.25825
- Gotlib J., Kiladjian J.J., Vannucchi A., Rambaldi A. Phase 2 Study of Pemigatinib (FIGHT-203; INCB054828) in Patients with Myeloid / Lymphoid Neoplasms (MLNs) with Fibroblast Growth Factor Receptor 1 (FGFR1) Rearrangement (MLN FGFR1). Blood. 2021;138(1):385. https://doi.org/10.1182/blood-2021-148103
- Anderson Ch., Khoury P., Makiya M., Sun X., et al. A Pilot Phase 2 Study of Ruxolitinib for the Treatment of Steroid-Refractory Hypereosinophilic Syndrome. Journal of Allergy and Clinical Immunology. 2024;153(2):AB64. https://doi.org/10.1016/j.jaci.2023.11.221
- Roufosse F., Kahn J.E., Rothenberg M.E., et al. Efficacy and Safety of Mepolizumab in Hypereosinophilic Syndrome: a Phase III, Randomized, Placebo-Controlled Trial. The Journal of Allergy and Clinical Immunology. 2020;146(6):1397–1405. https://doi.org/10.1016/j.jaci.2020.08.037
- Jonakowski M., Kuprys-Lipinska I., Lacwik P., et al. Hypereosinophilic Syndrome with Central Nervous System Involvement Treated with Anti-IL-5 Therapy. Multiple Sclerosis and Related Disorders. 2021;51:102871. https://doi.org/10.1016/j.msard.2021.102871
- Caminati M., Maule M., Benoni R., et al. Low-Dose Anti-IL 5 Treatment in Idiopathic Hypereosinophilic Syndrome: Towards a Precision Medicine Approach for Remission Maintenance. Orphanet Journal of Rare Diseases. 2023;18(1):302. https://doi.org/10.1186/s13023-023-02918-9
- Jue J.H., Shim Y.J., Park S., Kim D.H., Jung H.R. Korean Adolescent Patient with Manifestations of Lymphocyte Variant Hypereosinophilic Syndrome and Episodic Angioedema with Eosinophilia, Treated with Reslizumab. Iranian Journal of Allergy, Asthma, and Immunology. 2022;21(2):215–218. https://doi.org/10.18502/ijaai.v21i2.9229
- Buttgereit T., Bonnekoh H., Church M.K., et al. Effective Treatment of a Lymphocytic Variant of Hypereosinophilic Syndrome with Reslizumab. Journal der Deutsche Dermatologischen Gesellschaft = Journal of the German Society of Dermatology. 2019;17(11):1171–1172. https://doi.org/10.1111/ddg.13926
- Kuang F.L., Legrand F., Makiya M., et al. Benralizumab for PDGFRA-Negative Hypereosinophilic Syndrome. The New England Journal of Medicine. 2019;380(14):1336–1346. https://doi.org/10.1056/NEJMoa1812185
- Fujii K., Takahashi H., Hayakawa N., Iwasaki Y. Idiopathic Hypereosinophilic Syndrome in Remission with Benralizumab Treatment after Relapse with Mepolizumab. Respirology Case Reports. 2020;8(8):e00665. https://doi.org/1010.1002/rcr2.665
- Alen Coutinho I., Regateiro F.S., Loureiro C., Todo-Bom A. Benralizumab in Severe and Refractory PDGFRA-Negative Hypereosinophilic Syndrome. Journal of Clinical Immunology. 2021;41(3):688–690. https://doi.org/10.1007/s10875-020-00946-9
- Kosalka-Wegiel J., Milewski M., Siwiec A., et al. Severe Hypereosinophilic Syndrome Successfully Treated with a Monoclonal Antibody Against Interleukin 5 Receptor α-Benralizumab. Central-European Journal of Immunology. 2021;46(3):395–397. https://doi.org/10.5114/ceji.2021.108259
- Shi Y., Wang C. What We Have Learned about Lymphocytic Variant Hypereosinophilic Syndrome: A Systematic Literature Review. Clinical Immunology. 2022;237:108982. https://doi.org/10.1016/j.clim.2022.108982
- Radonjic-Hoesli S., Bruggen M.C., Feldmeyer L., et al. Eosinophils in Skin Diseases. Seminars in Immunopathology. 2021;43(3):393–409. https://doi.org/10.1007/s00281-021-00868-7
- Fourzali K., Yosipovitch G., Maderal A. An Approach to Hypereosinophilic Syndrome Presenting With Cutaneous Features. Dermatitis. 2022;33(6):387–395. https://doi.org/10.1097/DER.0000000000000803
Дополнительные файлы