Epidemiological and Pathophysiological Features of Gastric Cancer in Young Patients
- Authors: Matveeva L.V.1, Soldatova A.A.1, Savkina N.V.1
-
Affiliations:
- National Research Mordovia State University
- Issue: Vol 1, No 1 (2025)
- Pages: 41-50
- Section: Pathological physiology
- Submitted: 20.01.2025
- Accepted: 18.02.2025
- Published: 21.03.2025
- URL: https://medbiosci.ru/MedBiotech/article/view/277465
- DOI: https://doi.org/10.15507/3034-6231.001.202501.041-050
- EDN: https://elibrary.ru/jxynry
- ID: 277465
Cite item
Full Text
Abstract
Introduction. Gastric cancer maintains a significant position among malignant neoplasms in terms of incidence rates and cancer-specific mortality, with a higher prevalence in geriatric patients. In recent years, there has been a notable trend of increasing oncological morbidity in younger individuals. The aim of the study is to identify the epidemiological and pathophysiological characteristics of gastric cancer in young patients.
Materials and methods. Thematic search of scientific papers was carried out by keywords “early-onset gastric cancer”, “young cancer patients”, “gastric cancer incidence”, “cancer-specific mortality”, “cancer patient survival”, and “risk factors for tumor progression” in a cohort of full-text publications presented in the scientific electronic libraries eLibrary, PubMed, Scopus in 2015–2024.
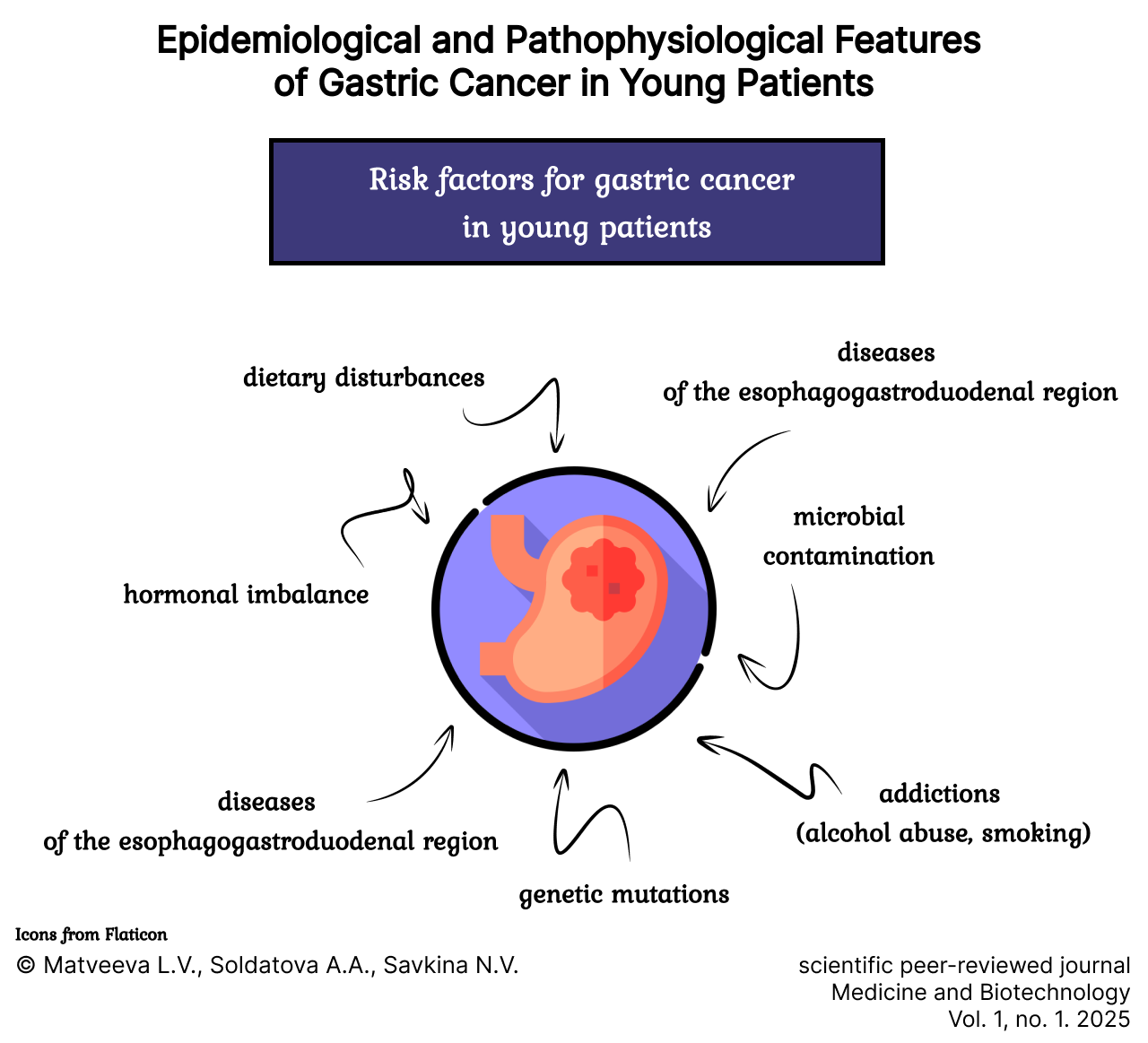
Results. The distribution of gastric cancer patients by age revealed that the highest proportion of cases among both the diagnosed and deceased was found in patients under 50 years of age in African countries, while the lowest was observed in European countries. Malignant gastric tumors in younger individuals typically lack clinical symptoms, especially in cases of diffuse-type cancer. This may not be due to the involvement of other organs but rather the appearance of clinical signs upon primary dissemination, leading to the development of complications. Risk factors for gastric cancer include dietary disturbances, addictions, diseases of the esophagogastroduodenal zone and the hepatopancreatobiliary system, genetic mutations, microbial contamination, and hormonal imbalances. A notable association is observed between the high frequency of diffuse gastric cancer and estrogen receptor expression in young women, particularly those with an unfavorable prognosis. The combination of tumor progression with the exacerbation of dysbiosis in the gastroduodenal zone, as well as a high frequency of lymphogenic metastasis, is also highlighted. In young patients, locally advanced and primarily disseminated neoplastic processes are dominant, as well as diffuse gastric involvement with a high degree of malignancy.
Discussion and conclusion. A promising avenue for research involves refining the pathogenic mechanisms of gastric carcinogenesis, particularly in relation to the study of estrogen-dependent proliferation of gastric epithelial cells, the variability of immune and mediator signaling induction in the context of gastric pathomicrobiome, and the potential for genuine reversals associated with lifestyle changes.
Full Text
Введение
Рак желудка (РЖ) сохраняет значимые позиции среди злокачественных новообразований (ЗНО) по темпам заболеваемости и онкоспецифической летальности [1]. По данным мировой статистики, РЖ занимает 5-е место в структуре ЗНО [2].
По оценкам GLOBOCAN, в странах мира в 2022 г. было диагностировано 968 784 случаев РЖ, соотношение больных мужчин и женщин составило 1,84:1; количество летальных исходов от РЖ – 660 175, из которых 65 % случаев – у мужчин. Таким образом, заболеваемость и смертность от РЖ составляли 9,2 и 6,1 случаев на 100 тыс. чел. соответственно [2; 3].
Традиционно наибольшая заболеваемость РЖ отмечается у пациентов пожилого и старческого возраста1,2. Однако в последние годы наметилась тенденция к увеличению заболеваемости РЖ лиц молодого возраста [4; 5]. Согласно Международной
классификации возраста, принятой Всемирной организацией здравоохранения, к молодому возрасту следует относить период от 18 до 44 лет [6].
Ранее подсчитано, что в 2019 г. РЖ был диагностирован у лиц 15–39 лет в 3,8 % случаев от числа всех заболевших в мире, онкоспецифические летальные исходы у пациентов молодого возраста отмечены в 2,91 % случаях [7]. Данные китайских ученых свидетельствуют о том, что частота РЖ в возрасте от 18 до 40 лет составляет 8,1 % [8].
Диагностика РЖ у молодых больных затрудняется отсутствием клинической симптоматики на этапе локализованного неопролиферативного процесса. Так, клиническая манифестация наследственного диффузного рака желудка (НДРЖ) регистрируется у большинства пациентов в среднем в 37–38 лет [2].
У пациентов до 40 лет, в соответствии с представленными результатами профилактических эзофагогастродуоденоскопий (ЭГДС), аденокарциномы с высокой степенью злокачественности и перстневидными клетками обнаруживаются в более 78 % случаев при наличии клинических симптомов ЗНО. Проведение ЭГДС с профилактической целью обеспечивает успешность эндоскопических оперативных вмешательств в 95,7 % случаев при раннем РЖ у молодых больных, радикальность хирургического лечения пациентов с клиническими проявлениями РЖ достигается лишь в половине случаев [9].
Исходя из приведенных свидетельств актуальности исследования раннего РЖ, целью исследования стало установление эпидемиологических и патофизиологических особенностей РЖ у больных молодого возраста.
Материалы и методы
Тематический поиск научных работ проводился по ключевым словам в когорте полнотекстовых публикаций, представленных в открытом доступе в научных электронных библиотеках eLibrary, PubMed, Scopus, ScienceDirect. Поисковые запросы включали литературные источники последних десяти лет. Из 1 151 статьи согласно рекомендациям PRISMA были отобраны 35 публикаций.
Результаты исследования
Эпидемиологические особенности рака желудка в странах мира. Анализ заболеваемости РЖ в географических регионах демонстрирует значимые различия в численности заболевших, умерших, возрастные и гендерные особенности [2; 4; 7]. Так, в 2022 г. наибольшее количество случаев заболевания и смертей от РЖ отмечалось в странах Азии – 71,41 и 70,07 % соответственно, значительно меньшее – в странах Европы (14 и 14,46 %), Америки (10,74 и 10,79 %), Африки (3,44 и 4,35 %), Океании (0,41 и 0,33 %) [2].
Считается, что на возраст до 50 лет приходится 2,7–15 % больных РЖ [10]. Распределение больных РЖ по возрасту установило наибольшую долю пациентов моложе 50 лет от числа заболевших в странах Африки, наименьшую – в европейских странах (рисунок). При этом численность онкобольных молодого возраста в 2022 г. практически во всех регионах африканского континента колебалась от 22,22 до 24,55 %, кроме Южной Африки, показатель которой (17,38 %) был вполне сопоставим с Южной Центральной Азией (17,66 %) [2].
Рисунок. Соотношение относительного количества больных раком желудка разных возрастов в 2022 г. в географических регионах, %
Figure. Ratio of the relative number of patients with gastric cancer of different ages in 2022 in geographic regions, %
Источник: составлено авторами статьи по материалам [2].
Source: Compiled by the authors of the article based on the materials [2].
Среди больных РЖ во всех географических регионах отмечается превалирование лиц мужского пола. В 2022 г. соотношение больных РЖ мужчин и женщин было максимальным в Восточной Азии (2,38:1), Западной и Восточной Европе (2,13:1 и 2,11:1 соответственно), Южной Америке и Южной Африке (2,09:1 и 2,08:1 соответственно). Минимальные гендерные различия больных РЖ регистрировались в Центральной, Западной и Восточной Африке при соответствующих соотношениях мужчины: женщины – 1,13:1, 1,19:1 и 1,22:1 [2]. РЖ у мужчин в азиатском регионе занимает 3-е ранговое место по заболеваемости – 15,6 случаев на 100 тыс. населения в 2022 г. [3].
Анализ заболеваемости РЖ за период 2003–2017 гг. выявил его снижение в большинстве стран мира. Однако лидерами оставались Япония, Южная Корея, Китай. В 2003–2017 гг. значимое нарастание численности молодых больных РЖ отмечалось у женщин Колумбии (+0,58) (здесь и далее данные приводятся в расчете на 100 тыс. чел.), у мужчин Австралии (+0,23), меньшее увеличение – у женщин Австрии, Соединенных Штатов Америки, Австралии, Франции (+0,08–0,06) [2]. Согласно исследованию, к 2035 г. прогнозируется рост заболеваемости молодых людей РЖ в Китае с 9,6 до 17,6, в Южной Корее – с 10,9 до 21,4, снижение в Японии до 6,6 к 2028 г., с увеличением до 7,1 к 2035 г. [11].
Онкоспецифическая летальность пациентов моложе 50 лет, подобно заболеваемости в 2022 г., была наибольшей в регионах африканского континента (20,14–23,23 %), кроме Южной Африки (14,85 %), наименьшей – в европейских странах (3,41–5,65 %). Количество смертей от РЖ у онкобольных молодого возраста было значимым в странах Южной Центральной Азии (16,17 %), Центральной Америки (14,2 %) [2]. Число летальных исходов от РЖ во всех географических регионах преобладало у лиц мужского пола. Соотношение умерших от РЖ мужчин и женщин было максимальным в Восточной Азии (2,55:1), Восточной и Западной Европе (2,20:1 и 2,15:1 соответственно), Западной Азии и Южной Америке (2,14:1 и 2,11:1 соответственно). Минимальные гендерные различия умерших от РЖ регистрировались в Центральной, Западной и Восточной Африке при соответствующих соотношениях мужчины: женщины – 1,12:1, 1,19:1 и 1,23:1 [3].
Эпидемиологические особенности рака желудка в Российской Федерации. В Российской Федерации (РФ), как и в других странах мира, РЖ чаще диагностируется у людей старше 50 лет, но отмечается рост числа выявленных случаев заболевания у молодых пациентов [5].
Динамика заболеваемости РЖ в РФ с 2012 по 2019 гг. демонстрировала тенденцию к увеличению численности контингента больных – с 94,1 до 96 (на 100 тыс. чел.), с последующим прогрессирующим уменьшением к 2023 г. до 90,5 больных. При этом индекс накопления контингента больных с ЗНО желудка увеличился с 4,0 в 2012 г. до 4,9 в 2022 г., что, вероятно, обусловлено снижением численности российского населения. Позитивным фактом является рост доли больных с морфологически подтвержденным диагнозом РЖ от числа больных с впервые в жизни установленным диагнозом ЗНО с 88,9 % в 2012 г. до 97,2 % в 2022 г. Удельный вес выявленных активно случаев заболевания РЖ из числа впервые выявленных ЗНО в РФ в 2012–2022 гг. увеличился вдвое с 6,8 до 13,7 %, но остается недостаточным. Позитивным следует расценивать факт роста доли случаев РЖ, обнаруженных на I–II стадии, из числа впервые обнаруженных ЗНО в России с 28,7 % в 2012 г. до 41,5 % в 2022 г. на фоне сокращения доли случаев РЖ, выявленных на III стадии, – с 26,6 % в 2012 г. до 19,6 % в 2022 г. Ежегодные изменения удельного веса случаев РЖ, выявленных на IV стадии, не были значимыми: +/–0–1,6 % в 2012–2021 гг., –2,1 % в 2022 г.3
В Республике Мордовия в 2023 г. диагноз РЖ был подтвержден морфологически в 100 % случаев: на I стадии в 7,9 %, на II – в 26,7 %, на III – в 25,7 %, на IV – в 39,7 %. ЗНО выявлялось активно у 27,6 % больных4.
При анализе показателей заболеваемости РЖ различных возрастно-половых групп населения РФ установлено, что в 2023 г. диагностировано 33 662 случая РЖ, из которых на долю молодых пациентов приходилось 4,08 % (1 372 больных), при этом по одному случаю ЗНО было выявлено у детей 0–4 и 5–9 лет, 13 случаев в 15–19-летнем возрасте, 30 – в 20–24 года, 48 – в 25–29 лет, 182 – в 30–34 года, 384 – в 35–39 лет, 715 – в 40–44-летнем возрасте5.
Отмечается, что злокачественные новообразования желудка в молодом возрасте обычно не имеют клинических признаков, особенно при диффузном типе рака [5].
Факторы риска развития рака желудка у больных молодого возраста. Представленные статистические данные свидетельствуют о снижении в РФ кумулятивного риска развития ЗНО желудка с 1,84 % в 2013 г. до 1,43 % в 2023 г., смерти от РЖ с 1,47 % в 2013 г. до 0,96 % в 2023 г.6
Считается, что в 90 % случаев РЖ развивается спорадически, в 5–10 % – на фоне отягощенной наследственности [12]. Факторами риска для развития РЖ являются нарушения диеты (избыточное потребление поваренной соли, копченостей), аддикции (злоупотребление алкоголем, курение), заболевания эзофагогастродуоденальной зоны и гепатопанкреатобилиарной системы, микробная контаминация, гормональный дисбаланс [1].
Генетические факторы риска развития рака желудка. В исследовании были идентифицированы потенциальные гены, отличающие больных ранним РЖ: варианты rs1799939 (RET), rs2959656 (MEN1) и rs55986963 (KIT) [13]. При этом мутации rs2959656 в 100 % случаев являлись гомозиготными.
Среди больных РЖ с отягощенной наследственностью по ЗНО доминируют молодые люди [12]. Наследственные синдромы отмечаются в 1–3 % случаев, их наличие доказывается анамнестическими данными, результатами гистологического и молекулярно-генетического исследований у пациентов с НДРЖ, с аденокарциномой и проксимальным полипозом желудка (АППЖ) или семейным кишечным подтипом РЖ (СКРЖ) [1; 12]. Неопролиферативный процесс при НДРЖ реализуется у пациентов до 20 лет в менее 1 % случаев, до 30 лет – в 4 %, к 50 годам у мужчин в 20 % случаев, у женщин – в 45 % [1; 14].
Для синдрома АППЖ свойственны аутосомно-доминантный тип наследования, множественные гиперпластические полипы тела и дна желудка размерами до 10 мм. СКРЖ также характеризуется аутосомно-доминантным типом наследования, но не имеет признаков полипоза. При синдроме ювенильного полипоза риск развития аденокарциномы желудка достигает 21 % [1].
Также имеются сведения, что в более раннем возрасте относительно других молекулярных подтипов ЗНО желудка диагностируется РЖ со стабильным геномом (средний возраст пациентов приходится на 59 лет). Для больных свойственен диффузный гистологический тип и доминирование мутаций в генах гуанозинтрифосфатаз и Е-кадгерина, расположенных в 3-й и 16-й хромосомах [15].
Микробная контаминация желудка. Инфицирование слизистой оболочки желудка (СОЖ) Helicobacter (H.) pylori считается основным индуцирующим фактором развития гастритического процесса с постепенной трансформацией и малигнизацией эпителиоцитов [1; 16]. Имеются указания на большую частоту инфекции H. pylori у молодых больных РЖ в возрасте до 30 лет [17]. Эти данные можно объяснить тропностью патогена к неизмененной СОЖ, что подтверждается снижением степени обсемененности при атрофическом пангастрите [16].
Ранее установлено, что для молодых больных РЖ на фоне инфекции H. pylori на I–III стадиях опухолевого процесса характерно клинически бессимптомное течение онкозаболевания, развитие недифференцированного рака c преимущественным поражением проксимальных отделов и тела желудка [18].
В свою очередь, фактором риска онкотрансформации эпителиоцитов желудка считается инфицирование вирусом Эпштейна – Барр (ВЭБ) из-за вариации интегративно-продуктивного взаимодействия геномов и в связи с высокой сопряженностью с раком желудка. РЖ, ассоциированный с ВЭБ-инфекцией, диагностируется у 10–33 % больных молодого возраста [19; 20]. Потенциально эффективным следует рассматривать диагностику ВЭБ-инфекции серологическим и/или молекулярно-генетическим методом у пациентов гастроэнтерологического профиля с решением вопроса о целесообразности назначения таргетной иммунотерапии [1].
Предположено, что рост распространенности аутоиммунного гастрита и дисбактериоза желудочного биотопа, вероятно, обусловленного широким использованием антибиотиков и антацидных средств, мог способствовать увеличению заболеваемости РЖ среди молодых людей [21]. В литературе отмечено, что прогрессирование неопролиферативного процесса сочеталось с усилением дисбиоза гастродуоденальной зоны: увеличением встречаемости и численности актиномицетов, вейллонелл, микрококков, нейссерий, превотелл, стафилококков, стрептококков, H. pylori, диморфных грибов – кандид при дефиците количества лактобацилл [22].
Гормональные изменения. В ряде источников постулируется превалирование женщин среди больных РЖ молодого возраста [7; 23; 24]. Ранее установлено, что у молодых пациенток экспрессия рецепторов эстрогена (ER) в малигнизированной СОЖ была значительно выше, чем в интактной ткани, и коррелировала с возрастом и стадией ЗНО.
Положительная экспрессия ERβ чаще наблюдалась у молодых пациенток с поздними стадиями РЖ [25].
В опубликованных данных отмечена корреляция между высокой частотой диффузного типа РЖ и экспрессией ER у молодых женщин, имеющих неблагоприятный прогноз [2]. Имеются указания на сопряженность признаков раннего начала РЖ у женщин с использованием прогестиновых пероральных контрацептивов, отсутствием в анамнезе сведений о беременности и лактации, поздними первыми родами [1].
Патофизиологические особенности рака желудка у больных молодого возраста. Локализация опухолевого процесса при раннем РЖ определяет различия вероятности регионарного лимфогенного метастазирования: в собственной пластинке СОЖ – 2–3 %, в подслизистом слое – 15–20 % [1]. Также отмечено, что у пациентов с ЗНО желудка молодого возраста частота лимфогенных метастазов может достигать 38,3 % [26].
В литературе имеются данные, что у молодых больных местно-распространенный и первично-диссеминированный неопролиферативные процессы являются доминирующими, как и диффузный тип поражения желудка при высокой степени злокачественности опухоли с наличием или без перстневидно-клеточного компонента [7; 23; 27].
Показано, что более 50 % случаев раннего РЖ представлены тубулярной аденокарциномой, имеющей благоприятный прогноз. Напротив, папиллярный тип раннего РЖ характеризуется более частой инвазией опухоли в подслизистый слой и метастазированием в регионарные лимфатические узлы [28]. Для перстневидно-клеточного рака с инвазией в пределах СОЖ свойственна очень низкая частота регионарного метастазирования и лимфоваскулярной инвазии (˂ 2 %) [29; 30].
Отсутствие диспепсических жалоб при наличии локализованного / местно-распространенного неопролиферативного процесса, характерное для течения РЖ у молодых пациентов, может быть обусловлено не вовлеченностью других органов, а появление клинической симптоматики при первичной диссеминации – развитием осложнений (В12-дефицитной анемии, белково-энергетической недостаточности, онкоспецифического асцита, метастатического поражения яичников) [23; 24].
Выживаемость при раке желудка. Ранее установлено, что показатели 5-летней общей выживаемости (ОВ) среди возрастных подгрупп 18–49 и 50–59 лет составляли 62,4 и 70,8 %, а метахронные перитонеальные интраабдоминальные рецидивы диагностировались в 3 раза чаще у более молодых пациентов (в 15,1 % случаев) [27]. В другом исследовании у молодых больных РЖ в возрасте до 30 лет результаты 1-, 3- и 5-летней ОВ были неудовлетворительными, составив 67,7, 24,2 и 14,1 % соответственно [31]. Американские ученые выявили, что у молодых больных РЖ показатели 5-летней ОВ для II, III, IV стадий составляли 43,9, 25,7 и 7,9 месяцев, у пациентов старшей возрастной группы – 61,5, 29,9 и 5,7 месяцев [32].
Радикальная гастрэктомия в объеме D2 с лимфаденэктомией не менее 25 узлов считается единственным предиктором долгосрочной выживаемости для пациентов разных возрастов [33].
Обсуждение и заключение
Заболеваемость РЖ снижается во многих странах мира благодаря профилактическим мерам поддержки здорового образа жизни (отказ от курения, злоупотребления алкоголем, изменение пищевых привычек с коррекцией диеты и массы тела), скрининговым диагностическим исследованиям, коррекции схем терапии заболеваний эзофагогастродуоденальной зоны и гепатопанкреатобилиарной системы. Несмотря на позитивную динамику, настораживающим фактом является тенденция к росту заболеваемости и летальности от РЖ людей молодого возраста.
Трудности диагностирования раннего РЖ у молодых пациентов определяются отсутствием клинической симптоматики на начальных этапах гастроканцерогенеза. Превалирование диффузного типа аденокарциномы высокой степени злокачественности, ранние лимфоваскулярная и периневральная инвазии являются неблагоприятными факторами прогноза у больных РЖ молодого возраста.
Уточнение патогенетических механизмов гастроканцерогенеза в аспекте исследования эстрогензависимой пролиферации эпителиоцитов желудка, вариативности индуцирующего иммунного и медиаторного сигналинга при желудочном патомикробиоценозе, вероятности истинных реверсий при изменении образа жизни представляется перспективным направлением для разработки скрининговых диагностических тестов, схем таргетной иммунотерапии, медико-социальных программ профилактики РЖ.
Учитывая наличие взаимосвязи экспрессии рецепторов эстрогена с малигнизацией желудка, определение количественных уровней онкомаркеров (раково-эмбрионального антигена, раковых антигенов 19-9, 72-4) может быть рекомендовано молодым женщинам, применяющим пероральную гормональную контрацепцию.
1 Состояние онкологической помощи населению России в 2022 г. ; под ред. А. Д. Каприна, В. В. Старинского, А. О. Шахзадовой. М. : МНИОИ им. П.А. Герцена − филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2022. 239 с.
2 Злокачественные новообразования в России в 2023 году (заболеваемость и смертность) ; под ред. А. Д. Каприна, В. В. Старинского, А. О. Шахзадовой. М. : МНИОИ им. П.А. Герцена − филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2024. 276 с.
3 Состояние онкологической помощи населению России в 2022 году.
4 Злокачественные новообразования в России в 2023 году (заболеваемость и смертность).
5 Там же. С. 31.
6 Там же. С. 20, 168.
About the authors
Lyubov V. Matveeva
National Research Mordovia State University
Author for correspondence.
Email: matveevaljubov1@mail.ru
ORCID iD: 0000-0001-9342-3157
SPIN-code: 6017-0118
Scopus Author ID: 55257966400
Dr.Sci. (Med.), Associate Professor of the Department of Immunology, Microbiology
and Virology with a course in Clinical Immunology and Allergology
Anna A. Soldatova
National Research Mordovia State University
Email: ashberrya@mail.ru
ORCID iD: 0000-0002-6970-2962
Postgraduate Student of the Department of Immunology, Microbiology and Virology
with a course in Clinical Immunology and Allergology
Natalia V. Savkina
National Research Mordovia State University
Email: nsavkina19@gmail.com
ORCID iD: 0009-0003-7446-0827
Student of the Medical Institute
Russian Federation, 68 Bolshevistskaya St., Saransk 430005References
- Pugaev D.M., Lyubchenko L.N., Ryabov A.B., Kaprin A.D. Early-Onset Gasrtric Cancer (Review). Siberian Journal of Oncology. 2023;22(6):153–171 (In Russ., abstract in Eng.). https://doi.org/10.21294/1814-4861-2023-22-6-153-171
- Tan N., Wu H., Cao M., et al. Global, Regional, and National Burden of Early-Onset Gastric Cancer. Cancer Biology and Medicine. 2024;21(8):667–678. https://doi.org/10.20892/j.issn.2095-3941.2024.0159
- Ferlay J., Ervik M., Lam F., et al. Global Cancer Observatory: Cancer Today (Version 1.1). Lyon, France: International Agency for Research on Cancer. Available from: https://gco.iarc.who.int/today (accessed: 07.02.2024).
- Sun F., Sun H., Mo X., Tang J., Liao Y., Wang S., Su Y., Ma H. Increased Survival Rates in Gastric Cancer, with a Narrowing Gender Gap and Widening Socioeconomic Status Gap: A Period Analysis from 1984 to 2013. Journal of Gastroenterology and Hepatology. 2018;33(4):837–846. https://doi.org/10.1111/jgh.14024
- Kovalenko N.V., Zhavoronkova V.V., Ivanov A.I., et al. Gastric Cancer in Patients Aged Younger and Older than 50 Years: Characteristics of Gastric Cancer and Survival Analysis. Siberian Journal of Oncology. 2022;21(2):24–37 (In Russ., abstract in Eng.). https://doi.org/10.21294/1814-4861-2022-21-2-24-37
- Dyussenbayev A. Age Periods оf Human Life. Advances in Social Sciences Research Journal. 2017;4(6). https://doi.org/10.14738/ assrj.46.2924
- Wu S.L., Zhang Y., Fu Y., Li J., Wang J.S. Gastric Cancer Incidence, Mortality and Burden in Adolescents and Young Adults: a Time-Trend Analysis and Comparison among China, South Korea, Japan and the USA. BMJ Open. 2022;12(7). https://doi.org/10.1136/bmjopen-2022-061038
- Zhao B., Mei D., Lv W., Lu H., et al. Clinicopathologic Features, Survival Outcome, and Prognostic Factors in Gastric Cancer Patients 18–40 Years of Age. Journal of Adolescent and Young Adult Oncology. 2020;9(4):514–521. https://doi.org/10.1089/jayao.2019.0162
- Moon H.H., Kang H.W., Koh S.J., et al. Clinicopathological Characteristics of Asymptomatic Young Patients with Gastric Cancer Detected during a Health Checkup. The Korean Journal of Gastroenterology. 2019;74(5):281–290. https://doi.org/10.4166/kjg.2019.74.5.281
- Kono Y., Kanzaki H., Iwamuro M., Kawano S., et al. Reality of Gastric Cancer in Young Patients: The Importance and Difficulty of the Early Diagnosis, Prevention and Treatment. Acta Medica Okayama. 2020;74(6):461–466. https://doi.org/10.18926/AMO/61204
- Ning F.L., Zhang N.N., Zhao Z.M., et al. Global, Regional, and National Burdens with Temporal Trends of Early-, Intermediate-, and Later-Onset Gastric Cancer from 1990 to 2019 and Predictions up to 2035. Cancers (Basel). 2022;14(21):5417. https://doi.org/10.3390/cancers14215417
- Oliveira C., Pinheiro H., Figueiredo J., Seruca R., Carneiro F. Familial Gastric Cancer: Genetic Susceptibility, Pathology, and Implications for Management. The Lancet. Oncology. 2015;16(2):60–70. https://doi.org/10.1016/S1470-2045(14)71016-2
- Machlowska J., Kapusta P., Baj J., et al. High-Throughput Sequencing of Gastric Cancer Patients: Unravelling Genetic Predispositions Towards an Early-Onset Subtype. Cancers (Bazel). 2020;12(7):1981. https://doi.org/10.3390/cancers12071981
- Blair V.R., McLeod M., Carneiro F., Coit D.G., et al. Hereditary Diffuse Gastric Cancer: Updated Clinical Practice Guidelines. The Lancet. Oncology. 2020;21(8):386–397. https://doi.org/10.1016/S1470-2045(20)30219-9
- Mikhaleva L.M., Midiber K.Yu., Pechnikova V.V., Vasyukova O.A., Gushchin M.Yu. Pathomorphological and Molecular Genetic Features of Diffuse Gastric Cancer. Bulletin of Siberian Medicine. 2021;20(2):168–175 (In Russ., abstract in Eng.). https://doi.org/10.20538/1682-0363-2021-2-168-175
- Matveeva L.V., Kapkaeva R.Kh., Mosina L.M., Kurusin V.M. [Changes in the Parietal Microbiota of the Stomach Depending on the Stage of Mucosal Atrophy Against the Background of an Active Inflammatory Process]. Medicinskij alʹmanah = Medical Almanac. 2016;1(41):44–47 (In Russ., abstract in Eng.). URL: https://clck.ru/3G3pRn (accessed: 10.01.2025).
- Moss S.F. The Clinical Evidence Linking Helicobacter pylori to Gastric Cancer. Cellular and Molecular Gastroenterology and Hepatology. 2016;3(2):183–191. https://doi.org/10.1016/j.jcmgh.2016.12.001
- Kono Y., Kanzaki H., Tsuzuki T., Takatani M., Nasu J., Kawai D., et al. A Multicenter Observational Study on the Clinicopathological Features of Gastric Cancer in Young Patients. Journal of Gastroenterology. 2019;54(5):419–426. https://doi.org/10.1007/s00535-018-1525-4
- Moore A., Hikri E., Goshen-Lago T., Barkan T., Morgenstern S., Brook E., et al. Young-Onset Gastric Cancer and Epstein–Barr Virus (EBV) – a Major Player in the Pathogenesis? BMC Cancer. 2020;20(1):34. https://doi.org/10.1186/s12885-020-6517-0
- Mazurek M., Szewc M., Sitarz M.Z., Dudzińska E., Sitarz R. Gastric Cancer: An Up-to-Date Review with New Insights into Early-Onset Gastric Cancer. Cancers (Bazel). 2024;16(18):3163. https://doi.org/10.3390/cancers16183163
- Ugai T., Sasamoto N., Lee H.Y., Ando M., et al. Is Early-Onset Cancer an Emerging Global Epidemic? Current Evidence and Future Implications. Nature Reviews. Clinical Oncology. 2022;19(10):656–673. https://doi.org/10.1038/s41571-022-00672-8
- Chudaykin A.N., Matveeva L.V., Soldatova A.A., et al. Helicobacter pylori and Dysbiosis of the Gastroduodenal Zone in Gastric Cancer. Modern problems of science and education. 2021;6 (In Russ.). https://doi.org/10.17513/spno.31303
- Rona K.A., Schwameis K., Zehetner J., Samakar K., et al. Gastric Cancer in the Young: An Advanced Disease with Poor Prognostic Features. Journal of Surgical Oncology. 2017;115(4):371–375. https://doi.org/10.1002/jso.24533
- Takatsu Y., Hiki N., Nunobe S., Ohashi M., et al. Clinicopathological Features of Gastric Cancer in Young Patients. Gastric Cancer. 2016;19(2):472–478. https://doi.org/10.1007/s10120-015-0484-1
- Zhou F., Xu Y., Shi J., Lan X., Zou X., Wang L., Huang Q. Expression Profile of E-Cadherin, Estrogen Receptors, and P53 in Early-Onset Gastric Cancers. Cancer Medicine. 2016;5(12):3403–3411. https://doi.org/10.1002/cam4.931
- Ji T., Zhou F., Wang J., Zi L. Risk Factors for Lymph Node Metastasis of Early Gastric Cancers in Patients Younger than 40. Bulletin of the School of Medicine (Baltimore). 2017;96(37):e7874. https://doi.org/10.1097/MD.0000000000007874
- Cheng L., Chen S., Wu W., Kuo Z.C., et al. Gastric Cancer in Young Patients: a Separate Entity with Aggressive Features and Poor Prognosis. Journal of Cancer Research and Clinical Oncology. 2020;146(11):2937–2947. https://doi.org/10.1007/s00432-020-03268-w
- Fang C., Shi J., Sun Q., Gold J.S., Xu G.F., Liu W.J., Zou X.P., Huang Q. Risk Factors of Lymph Node Metastasis in Early Gastric Carcinomas Diagnosed by WHO Criteria in 379 Chinese Patients. Chinese Journal of Digestive Diseases. 2016;17(8):526–537. https://doi.org/10.1111/1751-2980.12385
- Huang Q., Zou X. Clinicopathology of Early Gastric Carcinoma: An Update for Pathologists and Gastroenterologists. Gastrointestinal Tumors. 2017;3(3–4):115–124. https://doi.org/10.1159/000456005
- Pirogov S.S., Sokolov V.V., Belyakov M.M., Kaprin A.D. Early Gastric Cancer: the Modern Opinion. Siberian Journal of Oncology. 2017;16(5):71–86 (In Russ., abstract in Eng.). https://doi.org/10.21294/1814-4861-2017-16-5-71-86
- Zhou L., Jiang Z., Gu W., Han S. STROBE-Clinical Characteristics and Prognosis Factors of Gastric Cancer in Young Patients Aged ≤ 30 Years. Bulletin of the School of Medicine (Baltimore). 2021;100(26): e26336. https://doi.org/10.1097/MD.0000000000026336
- De B., Rhome R., Jairam V., Özbek U., Holcombe R.F., Buckstein M., Ang C. Gastric Adenocarcinoma in Young Adult Patients: Patterns of Care and Survival in the United States. Gastric Cancer. 2018;21(6):889–899. https://doi.org/10.1007/s10120-018-0826-x
- Japanese Gastric Cancer Treatment Guidelines 2021 (6th edition). Japanese Gastric Cancer Association. Gastric Cancer. 2023;26(1):1–25. https://doi.org/10.1007/s10120-022-01331-8
Supplementary files

Note