Проблемы лечения онкологических заболеваний на фоне беременности
- Авторы: Захаркина В.А.1, Скопин П.И.1
-
Учреждения:
- Национальный исследовательский Мордовский государственный университет
- Выпуск: Том 1, № 2 (2025)
- Страницы: 119-129
- Раздел: Фармакология, клиническая фармакология
- Статья получена: 13.04.2025
- Статья одобрена: 22.05.2025
- Статья опубликована: 23.06.2025
- URL: https://medbiosci.ru/MedBiotech/article/view/287362
- DOI: https://doi.org/10.15507/3034-6231.001.202502.119-129
- EDN: https://elibrary.ru/wrvdry
- ID: 287362
Цитировать
Полный текст
Аннотация
Введение. Проблема диагностики и лечения онкологических заболеваний у беременных женщин является актуальной, так как физиологические изменения могут затруднять раннее выявление болезни, а выбор терапии осложняется необходимостью минимизировать риски для плода и обеспечить эффективное лечение матери. Обсуждаются особенности выбора лечебной тактики, потенциальные риски для матери и плода, а также подходы к минимизации негативных последствий. Цель исследования – проанализировать тактику лечения онкологических заболеваний на фоне беременности, сравнить эффективность лечения и влияние на плод.
Материалы и методы. Осуществлен анализ современных литературных данных, позволивший систематизировать структуру онкологических заболеваний у беременных, варианты их лечения и возможные исходы. Дополнительно рассмотрен клинический случай из практики Республиканского онкологического диспансера, демонстрирующий реальные сложности и решения при ведении таких пациенток.
Результаты исследования. На основании проведенного анализа установлено, что ведение беременности на фоне онкологического заболевания требует тщательного баланса между эффективностью терапии и безопасностью для плода. В частности, хирургическое вмешательство и химиотерапия допустимы после первого триместра, тогда как лучевая терапия, по возможности, откладывается до послеродового периода. Однако данные о долгосрочных последствиях для ребенка остаются неоднозначными: одни исследования указывают на повышенные риски преждевременных родов и легкие когнитивные нарушения, тогда как другие не выявляют значимых отклонений.
Обсуждение и заключение. Полученные результаты подтверждают, что лечение онкозаболеваний у беременных требует индивидуального подхода, учитывающего как стадию болезни, так и срок гестации. Представленный клинический случай пациентки с распространенным раком прямой кишки в третьем триместре иллюстрирует возможность применения химиотерапии капецитабином и оксалиплатином в сочетании с мероприятиями по пролонгированию беременности для улучшения перинатального исхода. В то же время прогноз для матери остается зависимым от биологических характеристик опухоли, что подчеркивает необходимость дальнейших исследований в этой области.
Ключевые слова
Полный текст
Введение
Анализ данных показывает, что приблизительно у одной из тысячи беременных женщин в развитых странах диагностируется злокачественное новообразование. Эксперты прогнозируют увеличение частоты случаев рака у беременных, объясняя это более поздним возрастом наступления первой беременности у многих женщин. Несмотря на относительно невысокую распространенность, статистические данные указывают на то, что лидирующие позиции среди онкологических заболеваний, диагностируемых во время беременности, занимают рак шейки матки и рак молочной железы, суммарно составляющие около 62 % всех случаев. С меньшей частотой выявляются новообразования желудка и кишечника (около 11 % каждый), а также опухоли яичников (5,5 %) и лимфопролиферативные заболевания (4,9 %) [1].
Диагностика и терапия онкозаболеваний у беременных представляют собой сложные задачи. Методы диагностики требуют особой осторожности, чтобы минимизировать возможные риски для матери и ребенка. Оптимальный подход включает тщательную оценку рисков, связанных как с онкологией, так и с состоянием беременности, быстрое принятие решений о тактике лечения, комплексное применение терапевтических мер и последующее наблюдение за женщиной [2; 3].
Влияние онкозаболевания на ход беременности и прогноз зависит от стадии, на которой был установлен диагноз. При обнаружении рака на начальной стадии перспективы для будущей матери выглядят более благоприятными, остается достаточно времени для разработки адекватной стратегии лечения и предотвращения дальнейшего распространения опухоли. Однако если злокачественное новообразование диагностируется у беременной на поздней стадии, риски для здоровья плода возрастают экспоненциально. Помимо повышенной вероятности прерывания беременности и материнской смертности, существует значительная угроза развития гипоксии у плода. Высокая частота преждевременных родов, обычно происходящих около 35–36 недель гестации, приводит к тому, что примерно каждый четвертый младенец (25 %) не доживает до своего первого дня рождения. Уязвимость недоношенных детей, особенно в отношении развития респираторных заболеваний, обуславливает критическую необходимость участия в наблюдении квалифицированных неонатологов [3; 4].
В онкологической практике лечение часто предполагает комплексный подход, включающий хирургическое вмешательство, химиотерапевтическое лечение и лучевую терапию [5]. Ключевым принципом ведения беременности с сопутствующим онкологическим заболеванием является исключение химиотерапии в первом триместре, что продиктовано высоким риском для развивающегося плода. Негативные эффекты включают в себя как возникновение врожденных пороков, так и повышение вероятности спонтанного прерывания беременности, что обусловлено периодом активного формирования органов.
Анализ данных показывает, что тератогенный риск варьирует в зависимости от срока беременности: максимальный риск (10–20 %) наблюдается в первом триместре, в то время как в третьем триместре он значительно снижается (1,3 %) [2]. Клинические наблюдения подтверждают, что проведение химиотерапии во втором и третьем триместрах, как правило, не сопряжено с серьезными неблагоприятными последствиями для плода [1]. Наиболее критичным периодом является 5–10 неделя беременности, когда воздействие антиметаболитов и алкилирующих препаратов связано с высоким риском (16 %) появления серьезных пороков развития. Введение одного цитостатика в первом триместре увеличивает риск аномалий до 10 %. Комбинация нескольких препаратов повышает этот риск до 25 %. После 12 недель гестации химиотерапия ассоциируется с 27%-ной частотой акушерских осложнений, таких как задержка роста плода, преждевременные роды, антенатальная и интранатальная гибель плода, а также угнетение кроветворной функции. Лучевая терапия, ввиду ее потенциального тератогенного воздействия, не рекомендуется к применению во время беременности. В большинстве случаев следует рассмотреть возможность отсрочки лучевой терапии до послеродового периода, за исключением ситуаций, требующих немедленного вмешательства и облучения участков, расположенных на значительном удалении от матки [6; 13].
В таблице представлена тактика лечения онкологических заболеваний у беременных в зависимости от триместра.
Таблица. Тактика лечения онкологических заболеваний у беременных в зависимости от триместра беременности
Table. Tactics of treating oncological diseases in pregnant women depending on the trimester of pregnancy
Срок беременности, триместр / The term of pregnancy, trimester | Допустимые методы лечения / Acceptable treatment methods | Ограничения / риски / Limitations / Risks | Рекомендации / Recommendations |
I | Хирургическое лечение (при необходимости). Локальная терапия (для некоторых опухолей вдали от матки) / Surgical treatment (if needed). Local therapy (for some tumors away from the uterus) | Высокий тератогенный риск (10–20 %). Риск выкидыша до 25 % при химиотерапии. Абсолютное противопоказание для лучевой терапии / High teratogenic risk (10–20%). Risk of miscarriage up to 25% with chemotherapy. Absolute contraindication for radiation therapy | Рассмотреть отсрочку химиотерапии до II триместра. При агрессивных опухолях – обсудить прерывание беременности. Приоритет – хирургические методы / Consider delaying chemotherapy until the second trimester. For aggressive tumors, consider termination of pregnancy. Priority is given to surgical methods |
II | Химиотерапия (исключая противопоказанные препараты). Хирургическое лечение. Некоторые виды таргетной терапии / Chemotherapy (excluding contraindicated drugs). Surgical treatment. Some types of targeted therapy | Риск аномалий снижается до 1–3 %. Возможна задержка роста плода. Ограничения на лучевую терапию / The risk of abnormalities decreases to 1–3%. Fetal growth retardation is possible. Restrictions on radiation therapy | Оптимальный период для начала химиотерапии. Избегать антрациклинов в высоких дозах. Мониторинг развития плода каждые 3–4 недели / Optimal period for starting chemotherapy. Avoid high dose anthracyclines. Monitor fetal development every 3–4 weeks |
III | Полный спектр химиотерапии (кроме противопоказанных препаратов). Хирургическое лечение. Планирование досрочного родоразрешения при необходимости / Full spectrum of chemotherapy (except contraindicated drugs). Surgical treatment. Planning early delivery if necessary | Риск преждевременных родов (до 60 %). Неонатальная миелосупрессия / Risk of premature birth (up to 60%). Neonatal myelosuppression | Прекращение химиотерапии за 3 недели до родов. При стабильном состоянии – продление беременности до 35–37 недель. Плановое кесарево сечение при рисках / Stop chemotherapy 3 weeks before delivery. If the condition is stable, prolong pregnancy to 35–37 weeks. Planned cesarean section if there are risks |
Источник: по материалам [3]
Sourse: based on the materials [3]
Анализ воздействия химиотерапии и альтернативных методов лечения на развитие плода и ребенка является критически важным для расширения прав и возможностей будущих матерей и обеспечения персонализированного, пациентоориентированного подхода к лечению [3; 10]. В настоящее время существует ограниченное количество надежных исследований, посвященных изучению краткосрочных и долгосрочных последствий для детей, рожденных у матерей, столкнувшихся с диагнозом рака.
В 2020 г. было опубликовано исследование Международной сети специалистов по онкологии, бесплодию и беременности (International Network on Cancer, Infertility and Pregnancy, INCIP) под руководством Vandenbroucke Т., целью которого стало изучение развития ребенка через 6 лет после постановки диагноза «Рак» у матери и лечения во время беременности. Многоцентровое исследование 132 детей (97 из которых подвергались внутриутробному воздействию химиотерапии) показало, что лечение во II–III триместрах беременности относительно безопасно для когнитивного развития – общий IQ детей не отличался от контрольной группы. Однако выявлено снижение вербального IQ на 6 баллов и ухудшение зрительно-пространственной памяти, особенно выраженное (на 15,1 балла) у детей, потерявших матерей, что подчеркивает значение психосоциальных факторов. Основное осложнение – высокая частота преждевременных родов (60,6 %, в 6–8 раз выше нормы), преимущественно на 34–36,9 неделях. Специфические эффекты включали: повышение диастолического давления на 5,1 мм рт. ст., нарушения зрения (14,9 % против 5 % в контроле) и ототоксичность цисплатина (потеря слуха у 3 из 8 детей). Несмотря на выявленные отклонения, химиотерапия при беременности может считаться относительно безопасной при условии тщательного мониторинга, особенно за риском преждевременных родов, артериальным давлением, зрением и слухом (при использовании ототоксичных препаратов). Результаты подтверждают необходимость междисциплинарного подхода и длительного наблюдения за детьми, подвергавшимися внутриутробному воздействию противоопухолевой терапии [7; 12].
В 2017 г. коллектив американских ученых под руководством Меhtа А. опубликовал отчет о клиническом наблюдении беременности, наступившей на фоне терапии ипилимумабом. Описан случай 31-летней пациентки с метастатической меланомой, забеременевшей во время лечения ипилимумабом и альдеслейкином (вводимым интралезионно в низких дозах). Беременность завершилась рождением здорового мальчика. Комплексное обследование ребенка в возрасте 2 лет и 3 месяцев не выявило отклонений в физическом и нервно-психическом развитии, а также не было отмечено каких-либо иммунодефицитных состояний [8].
Этот случай показывает, что применение ипилимумаба и альдеслейкина во время беременности может не повлиять на развитие плода, но данных для однозначных выводов мало. Ипилимумаб относится к категории С по рискам для плода (исследования на животных выявили возможные осложнения, но у людей подтвержденных врожденных аномалий не зарегистрировано). PD-1-ингибиторы считаются более рискованными из-за их роли в иммунной толерантности при беременности. Хотя не доказано, что беременность ухудшает прогноз меланомы, иммуносупрессия может затруднять контроль болезни. Данный случай помогает при консультировании пациенток с незапланированной беременностью на фоне иммунотерапии, но требуется больше данных для оценки отдаленных последствий.
Китайские ученые в 2024 г. опубликовали ретроспективное когортное исследование, охватывающее период с 2003 по 2021 гг., посвященное влиянию онкологических заболеваний, диагностированных во время беременности, на акушерские и неонатальные исходы. Проведенное исследование, включающее анализ случаев 204 беременных пациенток с онкологическими заболеваниями из 7 ведущих китайских больниц, выявило ряд важных закономерностей в подходах к лечению и исходам беременности. Основные его выводы свидетельствуют о значительном влиянии демографических факторов на принятие решений о сохранении беременности – 17 % женщин (35 случаев) выбрали прерывание, причем 89 % из них были старше 28 лет и 77 % уже имели детей. Этот выбор коррелирует с общенациональной тенденцией увеличения возраста первых родов с 24 до 28 лет за последнее десятилетие [9].
Ключевой проблемой в ведении таких пациенток стала высокая частота ятрогенных преждевременных родов (30 % случаев), причем в 88 % случаев родоразрешение проводилось путем кесарева сечения. При этом частота врожденных аномалий (3,5 %), хотя и превышала показатели контрольной группы, оказалась ниже общенационального уровня, что может объясняться более высоким уровнем медицинской помощи в клиниках, участвовавших в исследовании [7; 9; 12].
Особого внимания заслуживает выявленный консервативный подход китайских врачей к химиотерапии – 86 % пациенток не получали противоопухолевое лечение во время беременности. Среди применяемых схем преобладали комбинации TP (таксаны + платина) при раке шейки матки и EC (эпирубицин + циклофосфамид) при раке молочной железы. Примечательно, что режим TP ассоциировался с неблагоприятными акушерскими исходами, что требует дополнительного изучения безопасности комбинированных схем, поскольку большинство существующих исследований касались лишь монотерапии [7; 9].
Важной проблемой стало преобладание цисплатина над более безопасным карбоплатином в клинической практике, несмотря на известные риски. Исследование также выявило положительную тенденцию – каждые 6 лет на 16 % увеличивается число пациенток, сохраняющих беременность, хотя этот рост обеспечивается в основном за счет хирургических вмешательств, а не химиотерапии [9].
Все три исследования подчеркивают сложность баланса между эффективным лечением матери и безопасностью плода, необходимость индивидуального подхода и важность дальнейших исследований в этой области [10; 12].
В публикации Van Gerwen M. и соавт. (2022) представлен комплексный анализ современных данных о влиянии материнского онкологического заболевания на нейрокогнитивное развитие ребенка, когда диагноз поставлен во время беременности. Авторы выделяют два основных пути воздействия: прямое – через трансплацентарную передачу химиотерапевтических препаратов, способных нарушать процессы нейрогенеза и церебральной гемодинамики у плода, и косвенное – опосредованное через такие факторы, как преждевременные роды, материнский стресс, нутритивный дефицит и системное воспаление, сопровождающее онкологический процесс. Особый интерес представляют данные о сравнительной безопасности химиотерапии во II–III триместрах, которая, хотя и не вызывает грубых пороков развития, может ассоциироваться с субклиническими когнитивными дефицитами, особенно в сфере памяти и исполнительных функций. Авторы справедливо отмечают значимые методологические ограничения существующих исследований, включая малые выборки и недостаточную продолжительность наблюдения за детьми [14].
Полученные данные имеют принципиальные клинические импликации: во-первых, они подтверждают относительную безопасность химиотерапии после первого триместра, но подчеркивают необходимость длительного нейропсихологического мониторинга потомства; во-вторых, делают акцент на важности профилактики преждевременных родов и адекватной нутритивной поддержки. Особую актуальность приобретает создание специализированных регистров для долгосрочного наблюдения за детьми, подвергшимися воздействию химиотерапии в утробе, что позволит уточнить отдаленные последствия и оптимизировать подходы к ведению беременности у онкологических пациенток.
Также важно психоэмоциональное состояние беременных пациенток, получающих лечение. Оно выступает значимым фактором, влияющим на приверженность терапии, физиологические параметры и, как следствие, на исходы лечения для матери и плода.
В 2024 г. Lee E. J. и др. опубликовали исследование, которое раскрывает сложный жизненный опыт беременных с онкологическими заболеваниями в Южной Корее, где культурные нормы и коллективистские ценности создают уникальные барьеры. Авторы выявили, что женщины сталкиваются с двойным бременем: медицинскими сложностями лечения рака и глубокой социокультурной стигматизацией, усугубляемой традиционными ожиданиями материнства. Особенно проблематичным оказалось противоречие между необходимостью агрессивного лечения и страхом навредить плоду, что в условиях ограниченной специализированной поддержки приводило к эмоциональному истощению. При этом стратегии преодоления, такие как опора на семейные связи или религиозные практики, отражают локальную специфику, но не всегда эффективны без профессионального сопровождения [15]. Исследование подчеркивает острую потребность в разработке культурно-ориентированных программ психологической и медицинской помощи, которые учитывали бы как клинические, так и социальные аспекты.
Можно сделать вывод, что психологическая поддержка беременных с онкологическими заболеваниями является неотъемлемой частью комплексного подхода к лечению. Диагностика рака во время беременности сопровождается выраженным психоэмоциональным стрессом, требующим незамедлительного вмешательства для предотвращения негативного влияния на материнское и фетальное здоровье. Медицинская поддержка включает информирование пациентки о диагнозе, вариантах лечения, их эффективности и возможных рисках, предоставляемое врачом, психологом или другим квалифицированным специалистом с учетом данных доказательной медицины. Оценка психоэмоционального состояния с использованием стандартизированных инструментов позволяет выявить признаки тревоги, депрессии и других психических расстройств, требующих фармакологической коррекции. Психотерапевтические методы, такие как когнитивно-поведенческая терапия, помогают пациенткам адаптироваться к изменениям, связанным с болезнью и лечением, а также разработать стратегии преодоления стресса. Необходимо обеспечить взаимодействие между акушерами-гинекологами, онкологами, психологами и другими специалистами для координации медицинской помощи. Кроме того, важно проводить мониторинг психологического состояния пациентки в послеродовом периоде и при необходимости оказывать специализированную помощь для профилактики и лечения послеродовой депрессии и тревоги. Акцент делается на своевременной диагностике и лечении психических расстройств, что способствует повышению приверженности лечению, улучшению качества жизни и снижению риска осложнений как для матери, так и для ребенка.
Материалы и методы
По результатам анализа литературных источников была определена структура онкологических заболеваний у беременных, варианты их лечения, эффективность, прогноз и влияние на плод. Также представлен клинический случай на базе Республиканского онкологического диспансера.
Результаты исследования
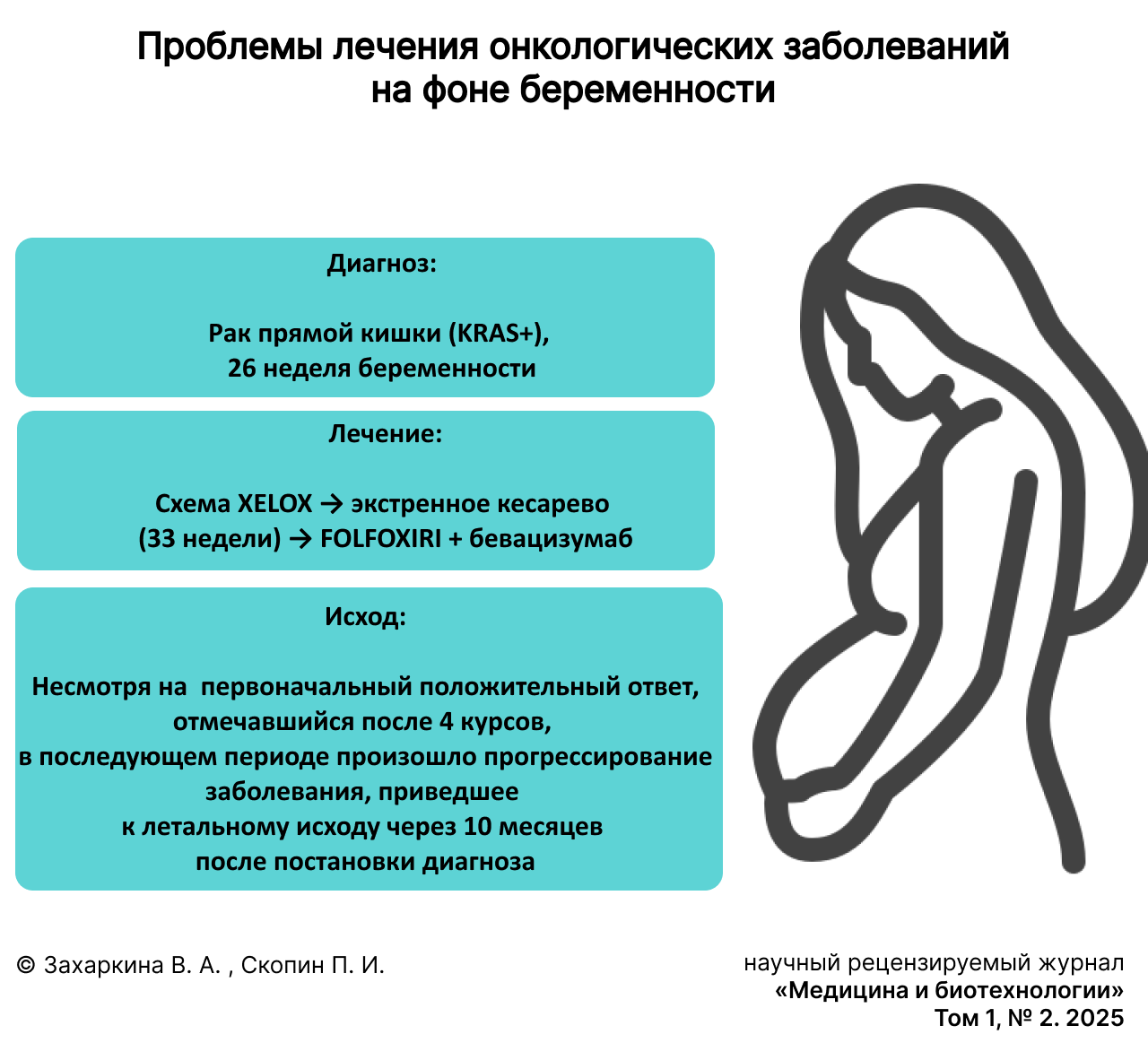
Рассмотрим один из вариантов лечения онкологического заболевания на примере клинического случая из практики государственного бюджетного учреждения здравоохранения Республики Мордовия «Республиканский онкологический диспансер» (ГБУЗ РМ «РОД»).
06.01.2023 г. пациентка М., 2001 г.р., на 26 неделе беременности с жалобами на боли в верхних отделах живота доставлена в Республиканскую клиническую больницу им. С. В. Каткова. При осмотре хирургом и выполнении ультразвукового исследования (УЗИ) органов брюшной полости были выявлены объемные образования печени, что послужило основанием для направления на консультацию онколога в ГБУЗ РМ «РОД».
Диагностические исследования показали:
- УЗИ брюшной полости обнаружило множественные метастазы в печени размером от 20 × 15 до 50 × 34 мм;
- онкомаркеры значительно превышали норму (уровень раково-эмбрионального антигена составил 145,68 нг/мл при норме ≤ 5);
- цитологическое исследование подтвердило аденогенную природу опухоли;
- последующая колоноскопия выявила ворсиноподобную опухоль прямой кишки со стенозом просвета;
- гистологически верифицирована аденокарцинома кишечного типа (G2);
- молекулярно-генетическое тестирование обнаружило KRAS-мутацию (экзон 3).
Перед медицинской командой стояла сложная задача выбора терапевтической стратегии, требующая баланса между интересами матери и плода. Было принято решение о пролонгировании беременности с одновременным проведением химиотерапии по схеме XELOX (CAPOX) с назначением капецитабина и оксалиплатина.
После двух курсов химиотерапии на 33 неделе беременности потребовалось экстренное кесарево сечение в связи с началом родовой деятельности. Послеродовое обследование подтвердило распространенность процесса: компьютерная томография выявила метастазы в легких, магнитно-резонансная томография показала обширное метастатическое поражение кишечника и печени.
Послеродовая терапия включала интенсивную химио-таргетную схему FOLFOXIRI (иринотекан + оксалиплатин + лейковорин) + бевацизумаб. Несмотря на первоначальный положительный ответ, отмечавшийся после 4 курсов, в последующем периоде произошло прогрессирование заболевания, приведшее к летальному исходу через 10 месяцев после постановки диагноза.
При детальном анализе данного клинического случая следует рассмотреть несколько альтернативных подходов к лечению. В качестве вариантов химиотерапии могла рассматриваться схема FOLFOX (оксалиплатин + лейковорин + фторурацил), обладающая более благоприятным профилем безопасности при беременности, или даже монотерапия 5-фторурацилом, хотя последний вариант характеризуется меньшей эффективностью. Альтернативные подходы к родоразрешению включали возможность более раннего планового кесарева сечения (на 30–32 неделях) или, напротив, отсрочку до 34–36 недель при условии тщательного мониторинга состояния пациентки. В случаях более ранней диагностики (во II триместре) теоретически мог обсуждаться вопрос о прерывании беременности, хотя этот вариант сопряжен с серьезными этическими дилеммами [7; 9; 11].
Этические аспекты данного случая представляют особый интерес и сложность. Основная дилемма заключалась в необходимости балансирования между приоритетом сохранения жизни матери и обеспечением жизнеспособности плода. При этом важно учитывать право пациентки на информированный отказ от лечения, а также возможное влияние религиозных и культурных факторов на принятие решений. Процесс информированного согласия в таких ситуациях особенно сложен из-за трудности объективной оценки рисков, значительной эмоциональной нагрузки и необходимости учета мнения членов семьи.
Представленный клинический случай демонстрирует сложности лечения рака прямой кишки при беременности, что также подтверждают следующие исследования.
В исследовании Rogers J. E. и соавт. (2022) представлен подробный анализ случаев колоректального рака (КРР), ассоциированного с беременностью, а также обзор современных литературных данных по данной проблеме. Как показали результаты исследования, средний возраст пациенток с КРР во время беременности составляет около 30 лет. Важным наблюдением стало преобладание левосторонней локализации опухолей и частая диагностика на поздних стадиях заболевания. При этом у большинства женщин отсутствовали традиционные факторы риска развития колоректального рака. Авторы особо подчеркивают, что постоянное ректальное кровотечение и упорная боль в животе должны рассматриваться как тревожные симптомы, требующие исключения онкологической патологии [16].
Особое внимание в исследовании уделено вопросам лечения. При анализе применения 5-фторурацила + оксалиплатина во время беременности (начиная со II триместра) отмечены благоприятные исходы для плода в пяти из семи наблюдавшихся случаев. Однако подчеркивается ограниченность данных о долгосрочных последствиях такой терапии для детей. Хирургическое лечение до 20-й недели беременности, согласно полученным данным, не увеличивает риск выкидыша по сравнению с общей популяцией.
Исследователи акцентируют внимание на проблеме поздней диагностики КРР у беременных, что связано как с неспецифичностью симптомов, так и с ограничениями в использовании диагностических методов.
Yan H. и соавт. опубликовали отчет о клиническом случае. У 32-летней пациентки на 28-й неделе беременности диагностировали аденокарциному сигмовидной кишки (стадия IIIB, KRAS-мутантная). Из-за позднего выявления химиотерапию отложили до послеродового периода. На 34-й неделе выполнили кесарево сечение, после чего провели 6 курсов FOLFOX с достижением ремиссии.
В представленном случае диагноз был установлен только в III триместре, что ограничило возможности лечения. Успешное родоразрешение путем кесарева сечения на 34-й неделе и достижение ремиссии после 6 курсов FOLFOX демонстрируют возможность эффективного лечения КРР при беременности, однако подчеркивают необходимость повышения настороженности в отношении онкологических заболеваний у беременных, ранней диагностики и мультидисциплинарного подхода к ведению таких пациенток [17].
Данные случаи иллюстрирует возможные подходы к лечению КРР у беременных, но есть необходимость более масштабных исследований для разработки доказательных рекомендаций по лечению онкозаболеваний при беременности.
Обсуждение и заключение
Ведение онкологических пациенток во время беременности требует тщательно сбалансированной индивидуальной стратегии, позволяющей сохранить здоровье матери при максимально возможной защите развивающегося плода от негативного воздействия терапии. Международная медицинская практика за последние два десятилетия все чаще склоняется к комплексному лечению без прерывания беременности, что позволяет повысить шансы на выживание как матери, так и ребенка. Анализ имеющихся исследований свидетельствует об отсутствии существенных различий в состоянии здоровья детей, чьи матери получали химиотерапию во время беременности, и контрольной группы. Продление беременности в сочетании с химиотерапевтическим лечением представляется возможным при условии тщательного подбора препаратов с минимальным потенциальным воздействием на плод. Хотя влияние химиопрепаратов на развивающийся организм может быть сведено к минимуму, полностью исключить его, к сожалению, не представляется возможным. Кроме того, необходимо учитывать вероятность отдаленных последствий воздействия препаратов на здоровье ребенка в будущем.
На основании анализа клинических случаев можно сформулировать несколько важных рекомендаций. Во-первых, необходима разработка четких институциональных протоколов ведения подобных сложных ситуаций. Во-вторых, следует ввести обязательное этическое консультирование при принятии решений. В-третьих, целесообразно создание национального регистра подобных прецедентов для накопления доказательной базы. И наконец, особое внимание должно уделяться вопросам психологической поддержки пациенток и их семей, сталкивающихся с аналогичной тяжелой ситуацией.
Представленные данные наглядно демонстрируют сложности, с которыми сталкиваются врачи при лечении онкологических заболеваний у беременных, и подчеркивает необходимость комплексного подхода, учитывающего как медицинские, так и этические аспекты подобных обстоятельств.
Об авторах
Виктория Альбертовна Захаркина
Национальный исследовательский Мордовский государственный университет
Автор, ответственный за переписку.
Email: vicktoria.belina@yandex.ru
ORCID iD: 0009-0001-5419-511X
студент Медицинского института
Россия, 430005,г. Саранск, ул. Большевистская, д. 68Павел Игоревич Скопин
Национальный исследовательский Мордовский государственный университет
Email: skopinpi@mrsu.ru
ORCID iD: 0000-0001-6662-5052
SPIN-код: 5755-3990
Scopus Author ID: 57220121011
ResearcherId: Q-4300-2017
доктор медицинских наук, доцент, директор Медицинского института
Россия, 430005, г. Саранск, ул. Большевистская, 68Список литературы
- Dalmartello M., Negri E., La Vecchia C., Scarfone G., Buonomo B., Peccatori F.A. et al. Frequency of Pregnancy-Associated Cancer: A Systematic Review of Population-Based Studies. Cancers (Basel). 2020;12(6):1356. https://doi.org/10.3390/cancers12061356
- Javitt M.C. Cancer in Pregnancy: Overview and Epidemiology. Abdominal Radiology (New York). 2023;48(5):1559–1563. https://doi.org/10.1007/s00261-022-03633-y
- Wolters V., Heimovaara J., Maggen C., Cardonick E., Boere I., Lenaerts L. et al. Management of Pregnancy in Women with Cancer. International Journal of Gynecological Cancer. 2021;31(3):314–322. https://doi.org/10.1136/ijgc-2020-001776
- Cottreau C.M., Dashevsky I., Andrade S.E., Li D.-K., Nekhlyudov L., Raebel M.A. et al. Pregnancy-Associated Cancer: A U.S. Population-Based Study. Journal of Women’s Health (Larchmt). 2019;28(2):250–257. https://doi.org/10.1089/jwh.2018.6962
- Sekine M., Kobayashi Y., Tabata T., Sudo T., Nishimura R., Matsuo K. et al. Malignancy during Pregnancy in Japan: an Exceptional Opportunity for Early Diagnosis. BMC Pregnancy and Childbirth. 2018;18(1):50. https://doi.org/10.1186/s12884-018-1678-4
- Паяниди Ю.Г., Боровкова Е.И., Доброхотова Ю.Э., Арутюнян А.М. Тактика ведения беременных с инвазивным раком шейки матки. РМЖ. Мать и дитя. 2019;2(2):135–138. https://doi.org/10.32364/2618-8430-2019-2-2-135-138
- Vandenbroucke T., Verheecke M., van Gerwen M., van Calsteren K., Halaska M.J., Fumagalli M. et al. Child Development at 6 Years after Maternal Cancer Diagnosis and Treatment during Pregnancy. European Journal of Cancer (Oxford, England). 2020;138:57–67. https://doi.org/10.1016/j.ejca.2020.07.004
- Mehta A., Kim K.B., Minor D.R. Case Report of a Pregnancy during Ipilimumab Therapy. Journal of Global Oncology. 2018;4:1–3. https://doi.org/10.1200/JGO.17.00019
- Huang X., Zhang C., Zhu J., Li Y., Tang J. Influence of Cancer in Pregnancy on Obstetric and Neonatal Outcomes: an Observational Retrospective Cohort Study. Journal of Gynecologic Oncology. 2024;35(6):e74. https://doi.org/10.3802/jgo.2024.35.e74
- Pentheroudakis G., Orecchia R., Hoekstra H.J., Pavlidis N., ESMO Guidelines Working Group. Cancer, Fertility and Pregnancy: ESMO Clinical Practice Guidelines for Diagnosis, Treatment and Follow-Up. Annals of Oncology. 2010;21(Suppl.5):v266–v273. doi: 10.1093/annonc/mdq198
- Davutoğlu A.E., Madazlı R., Yılmaz N., Ozel A., Uludag S., Sozen I. Pregnancy in Cancer Patients and Survivors; Experience of a University Hospital in Turkey. Journal of Obstetrics and Gynaecology. 2017;37(8):1015–1019. https://doi.org/10.1080/01443615.2017.13182652
- Zagouri F., Dimitrakakis C., Marinopoulos S., Tsigginou A., Dimopoulos M.-A. Cancer in Pregnancy: Disentangling Treatment Modalities. ESMO Open. 2016;1(3):e000016. https://doi.org/10.1136/esmoopen-2015-000016
- Baulies S., Cusidó M., Tresserra F., Rodríguez I., Ubeda B., Ara C. et al. Cáncer de Mama Asociado al Embarazo: Estudio Analítico Observacional. Medicina Clinica (Barcelona). 2014;142(5):200–204 (In Span., abstract in Eng.). https://doi.org/10.1016/j.medcli.2012.12.020
- Van Gerwen M., Vandenbroucke T., Gorissen A.-S., van Grotel M., van den Heuvel-Eibrink M., Verwaaijen E. et al. Executive Functioning in 6-Year-Old Children Exposed to Chemotherapy in Utero. Early Human Development. 2020;151:105198. https://doi.org/10.1016/j.earlhumdev.2020.105198
- Lee D.B., Kim H.W., Lee Y.J., Kim J. Lived Experiences of Pregnant Women with Cancer in South Korea: A Qualitative Study. Asian Nursing Research. 2024;18(3):296-304. https://doi.org/10.1016/j.anr.2024.07.009
- Rogers J.E., Woodard T.L., Gonzalez G.M., Dasari A., Johnson B., Morris V.K. et al. Colorectal Cancer during Pregnancy or Postpartum: Case Series and Literature Review. Obstetric Medicine. 2022;15(2):118–124. https://doi.org/10.1177/1753495X211041228
- Yang H., Han S. Colorectal Cancer during Pregnancy: A Case Report and Literature Review. Journal of Gastrointestinal Oncology. 2021;12(2):885–891. https://doi.org/10.21037/jgo-21-31
Дополнительные файлы